o 33º elemento da tabela periódica é o arsénio. O elemento do grupo-15 é arsênico e seu símbolo é ‘As’. O arsênico forma ligações através de seus elétrons de Valência. Este artigo discute em detalhes os elétrons de Valência do arsênico. Esperançosamente, depois de ler este artigo, você saberá em detalhes sobre os elétrons de valência de arsênico(as).
Índice
- quantos elétrons e prótons o arsênico tem?
- quais são os elétrons de Valência do arsênico(As)?
- como você calcula o número de elétrons de Valência em um átomo de arsênico?
- Passo-1: determinando o número total de elétrons no arsênico(As)
- Passo-2: Precisa fazer configuração eletrônica de arsênico
- Passo-3: Determine a camada de Valência e calcule o total de elétrons
- quantos elétrons de Valência o íon arsênico(AS3-) tem?
- Qual é a valência do arsênico?
quantos elétrons e prótons o arsênico tem?
o núcleo está localizado no centro do átomo. Prótons e nêutrons estão localizados no núcleo. O número atômico de arsênico(AS) é 33. O número atômico é o número de prótons.
ou seja, o número de prótons no arsênico é de trinta e três. Elétrons iguais aos prótons estão localizados em uma concha circular fora do núcleo. Ou seja, um átomo de arsênico tem um total de trinta e três elétrons.
quais são os elétrons de Valência do arsênico(As)?
o número total de elétrons na última camada após a configuração eletrônica do arsênico é chamado de elétrons de Valência do arsênico. O elétron de Valência é o número total de elétrons na última órbita(concha).

os elétrons de Valência determinam as propriedades do elemento e participam da formação de ligações. O 33º elemento da tabela periódica é o arsênico(as). Ou seja, o átomo do elemento arsênico tem um total de trinta e três elétrons.
a configuração eletrônica do arsênico mostra que a última camada de arsênico tem um total de cinco elétrons. Ou seja, podemos facilmente dizer que os elétrons de Valência do arsênico são cinco. Há um artigo neste site detalhando a configuração eletrônica do arsênico, você pode lê-lo se quiser.
como você calcula o número de elétrons de Valência em um átomo de arsênico?
agora saberemos como determinar facilmente os elétrons de Valência do arsênico. O elétron de Valência deve ser determinado seguindo algumas etapas. A configuração eletrônica é uma delas. Não é possível determinar o elétron de Valência sem configuração de elétrons.
conhecendo a configuração do elétron da maneira certa, é muito fácil determinar os elétrons de valência de todos os elementos. Há um artigo publicado neste site detalhando a configuração do electron, você pode lê-lo se quiser. No entanto, este artigo discute brevemente a configuração do elétron.O cientista Niels Bohr foi o primeiro a dar uma ideia da órbita do átomo(concha). Ele forneceu um modelo do átomo em 1913. A ideia completa da órbita é dada lá. Os elétrons do átomo giram em torno do núcleo em um determinado caminho circular. Esses caminhos circulares são chamados de órbita (concha). Essas órbitas são expressas por N.
K é o nome da primeira órbita(concha), L é o segundo, M é o terceiro, N é o nome da quarta concha. A capacidade de retenção de elétrons de cada órbita é 2n2.
agora,
- n = 1 para K órbita.
a capacidade de retenção de elétrons da órbita K é 2N2 = 2 × 12 = 2 elétrons. - para órbita L, n = 2.
a capacidade de retenção de elétrons da órbita L é 2N2 = 2 × 22 = 8 elétrons. - n=3 para M órbita.
a capacidade máxima de retenção de elétrons na órbita M é 2N2 = 2 × 32 = 18 elétrons. - n=4 para n órbita.
a capacidade máxima de retenção de elétrons em n órbita é 2N2 = 2 × 42 = 32 elétrons.
além deste método, a configuração de elétrons pode ser feita através de sub-órbitas. O físico alemão Aufbau propôs pela primeira vez uma ideia de configuração de elétrons por meio de sub-órbitas. O método Aufbau é fazer a configuração de elétrons através do nível de subenergia.
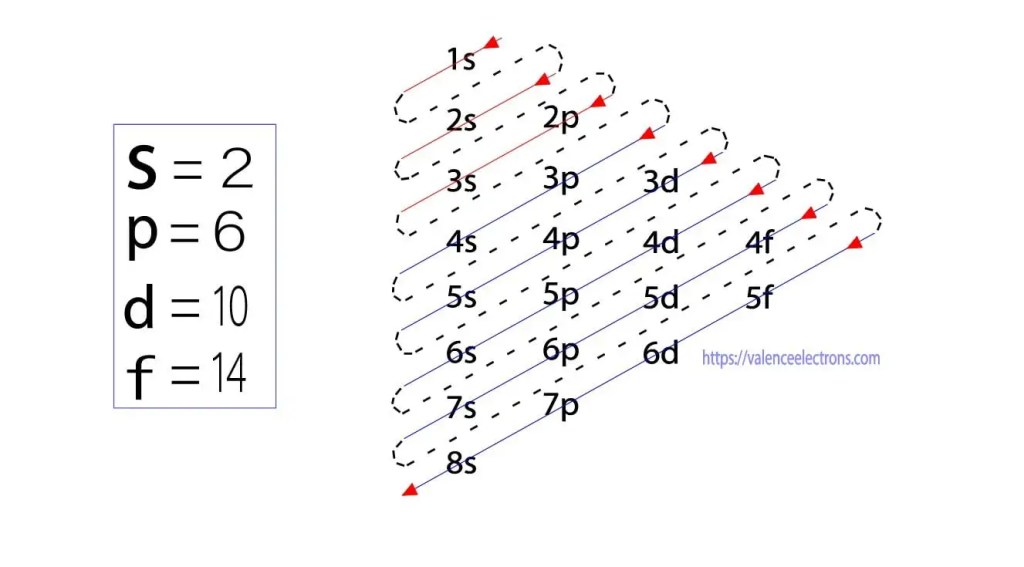
esses sub-orbitais são expressos por’l’. O princípio Aufbau é que os elétrons presentes no átomo primeiro completarão o orbital de energia mais baixa e, em seguida, gradualmente continuarão a completar o orbital de energia mais alta. Esses orbitais são chamados s, p, d, F. A capacidade de retenção de elétrons desses orbitais é s = 2, p = 6, d = 10 e f = 14.
no entanto, os elétrons de Valência podem ser facilmente identificados organizando os elétrons de acordo com o princípio de Bohr. Agora vamos aprender como determinar o elétron de Valência do arsênico (As).
Passo-1: determinando o número total de elétrons no arsênico(As)
1º precisamos saber o número total de elétrons no átomo de arsênico. Para saber o número de elétrons, você precisa saber o número de prótons no arsênico. E para saber o número de prótons, você precisa saber o número atômico do elemento arsênico.
para saber o número atômico, precisamos tomar a ajuda de uma tabela periódica. É necessário conhecer o número atômico de elementos de arsênico(as) da tabela periódica. O número atômico é o número de prótons. E elétrons iguais aos prótons estão localizados fora do núcleo.

isto é, podemos finalmente dizer que existem elétrons igual ao número atômico do átomo de arsênio. Da tabela periódica, vemos que o número atômico de arsênico(As) é 33. Ou seja, o átomo de arsênico tem um total de trinta e três elétrons.
Passo-2: Precisa fazer configuração eletrônica de arsênico
Passo-2 é muito importante. Nesta etapa, os elétrons do arsênico devem ser organizados. Sabemos que os átomos de arsênico(as) têm um total de trinta e três elétrons. A configuração eletrônica do arsênico mostra que existem dois elétrons na camada K, oito na camada L, dezoito na camada M e cinco na camada N(órbita).

ou seja, a primeira camada de arsênico tem dois elétrons, a segunda camada tem oito elétrons, a 3ª camada tem dezoito elétrons e a 4ª camada(última órbita) tem cinco elétrons. O número de elétrons por camada de arsênico(AS) é 2, 8, 18, 5. A configuração eletrônica do arsênico através da sub-órbita é 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3.
Passo-3: Determine a camada de Valência e calcule o total de elétrons
a terceira etapa é diagnosticar a camada de Valência. A última concha após a configuração do elétron é chamada de concha de Valência (órbita). O número total de elétrons em uma camada de Valência é chamado de elétron de Valência. A configuração eletrônica do arsênico(as) mostra que a última camada de arsênico tem cinco elétrons. Portanto, os átomos de arsênico têm 5 elétrons de Valência.
quantos elétrons de Valência o íon arsênico(AS3-) tem?
os elementos que possuem 5, 6 ou sete elétrons na última camada(órbita) recebem os elétrons na última camada durante a formação da ligação. Os elementos que recebem elétrons e formam ligações são chamados de Ânions. Ou seja, o arsênico(AS) é um elemento aniônico.
As + 3e– → As3-
durante a formação de ligações de arsênico, a última camada recebe elétrons e os transforma em íons arsênico(AS3-). A configuração eletrônica dos íons arsênico (As3-) é 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4P6.
a configuração eletrônica dos íons arsênico mostra que os íons arsênico(As3-) têm quatro camadas e a última camada tem oito elétrons (4s2 4p6). A configuração eletrônica mostra que o átomo de arsênico adquiriu a configuração eletrônica do criptônio. Como a última camada de um íon arsênico tem oito elétrons, os elétrons de Valência dos íons arsênico(As3-) são oito.
Qual é a valência do arsênico?
a capacidade de um átomo de um elemento de se juntar a outro átomo durante a formação de uma molécula é chamada de Valência (Valência). O número de elétrons não pareados na última órbita de um elemento é a valência desse elemento. Na configuração eletrônica do arsênico(as), vemos que existem cinco elétrons na última camada do arsênico. Portanto, a valência do arsênico(As) é 5.

novamente, a valência é determinada a partir da configuração eletrônica do elemento no estado excitado. A configuração eletrônica do arsénio no estado excitado é Como*(33) = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4px1 4py1 4pz1. Aqui, a configuração eletrônica do arsênico mostra que três elétrons não pareados existem na última camada. Neste caso, a valência do átomo de arsênico é 3.
os estados de oxidação do arsênico dependem da formação da ligação. O estado de oxidação do arsênico é +3. O estado de oxidação do arsênico + 3 tem sido usado em arsenieto de gálio (GaAs). A valência do arsênico neste composto é 3.