Das 33. Element des Periodensystems ist Arsen. Das Element der Gruppe-15 ist Arsen und sein Symbol ist ‚As‘. Arsen bildet Bindungen durch seine Valenzelektronen. Dieser Artikel beschreibt ausführlich die Valenzelektronen von Arsen. Hoffentlich wissen Sie nach dem Lesen dieses Artikels ausführlich über die Arsen (As) -Valenzelektronen Bescheid.
Inhaltsverzeichnis
- Wie viele Elektronen und Protonen hat Arsen?
- Was sind die Valenzelektronen von Arsen(As)?
- Wie berechnet man die Anzahl der Valenzelektronen in einem Arsenatom?
- Schritt 1: Bestimmung der Gesamtzahl der Elektronen in Arsen (As)
- Schritt-2: Tun müssen elektron konfiguration von arsen
- Schritt-3: Bestimmen Sie die Valenzschale und berechnen Sie die Gesamtelektronen
- Wie viele Valenzelektronen hat das Arsenion(As3-)?
- Was ist die Wertigkeit von Arsen?
Wie viele Elektronen und Protonen hat Arsen?
Der Kern befindet sich im Zentrum des Atoms. Protonen und Neutronen befinden sich im Kern. Die Ordnungszahl von Arsen (As) beträgt 33. Die Ordnungszahl ist die Anzahl der Protonen.
Das heißt, die Anzahl der Protonen in Arsen beträgt dreiunddreißig. Elektronen, die Protonen gleich sind, befinden sich in einer kreisförmigen Hülle außerhalb des Kerns. Das heißt, ein Arsenatom hat insgesamt dreiunddreißig Elektronen.
Was sind die Valenzelektronen von Arsen(As)?
Die Gesamtzahl der Elektronen in der letzten Schale nach der Elektronenkonfiguration von Arsen wird als Valenzelektronen von Arsen bezeichnet. Das Valenzelektron ist die Gesamtzahl der Elektronen in der letzten Umlaufbahn(Schale).

Die Valenzelektronen bestimmen die Eigenschaften des Elements und sind an der Bildung von Bindungen beteiligt. Das 33. Element im Periodensystem ist Arsen(As). Das heißt, das Atom des Arsenelements hat insgesamt dreiunddreißig Elektronen.
Die Elektronenkonfiguration von Arsen zeigt, dass die letzte Schale von Arsen insgesamt fünf Elektronen hat. Das heißt, wir können leicht sagen, dass die Valenzelektronen von Arsen fünf sind. Es gibt einen Artikel auf dieser Seite, der die Elektronenkonfiguration von Arsen beschreibt, Sie können es lesen, wenn Sie wollen.
Wie berechnet man die Anzahl der Valenzelektronen in einem Arsenatom?
Jetzt werden wir wissen, wie man die Valenzelektronen von Arsen leicht bestimmt. Das Valenzelektron muss in wenigen Schritten bestimmt werden. Die Elektronenkonfiguration ist eine davon. Es ist nicht möglich, das Valenzelektron ohne Elektronenkonfiguration zu bestimmen.
Wenn man die Elektronenkonfiguration richtig kennt, ist es sehr einfach, die Valenzelektronen aller Elemente zu bestimmen. Auf dieser Website wurde ein Artikel veröffentlicht, in dem die Elektronenkonfiguration beschrieben wird. Dieser Artikel beschreibt jedoch kurz die Elektronenkonfiguration.
Der Wissenschaftler Niels Bohr gab als erster eine Vorstellung von der Umlaufbahn des Atoms(Schale). Er lieferte 1913 ein Modell des Atoms. Die vollständige Vorstellung von der Umlaufbahn ist dort gegeben. Die Elektronen des Atoms drehen sich in einer bestimmten Kreisbahn um den Kern. Diese Kreisbahnen werden Orbit(Schale) genannt. Diese Umlaufbahnen werden durch n ausgedrückt.
K ist der Name der ersten Umlaufbahn(Schale), L ist die zweite, M ist die dritte, N ist der Name der vierten Schale. Die Elektronenhaltekapazität jeder Umlaufbahn beträgt 2n2.
Jetzt,
- n = 1 für K Orbit.
Die Elektronenhaltekapazität von K Orbit ist 2n2 = 2 × 12 = 2 Elektronen. - Für L Orbit, n = 2.
Die Elektronenhaltekapazität der L-Bahn beträgt 2n2 = 2 × 22 = 8 Elektronen. - n=3 für M Umlaufbahn.
Die maximale Elektronenhaltekapazität im M-Orbit beträgt 2n2 = 2 × 32 = 18 Elektronen. - n=4 für N Orbit.
Die maximale Elektronenhaltekapazität im N-Orbit beträgt 2n2 = 2 × 42 = 32 Elektronen.
Zusätzlich zu dieser Methode kann die Elektronenkonfiguration durch Suborbits erfolgen. Der deutsche Physiker Aufbau schlug zunächst eine Idee der Elektronenkonfiguration durch Suborbits vor. Die Aufbau-Methode besteht darin, die Elektronenkonfiguration über das Sub-Energie-Niveau durchzuführen.
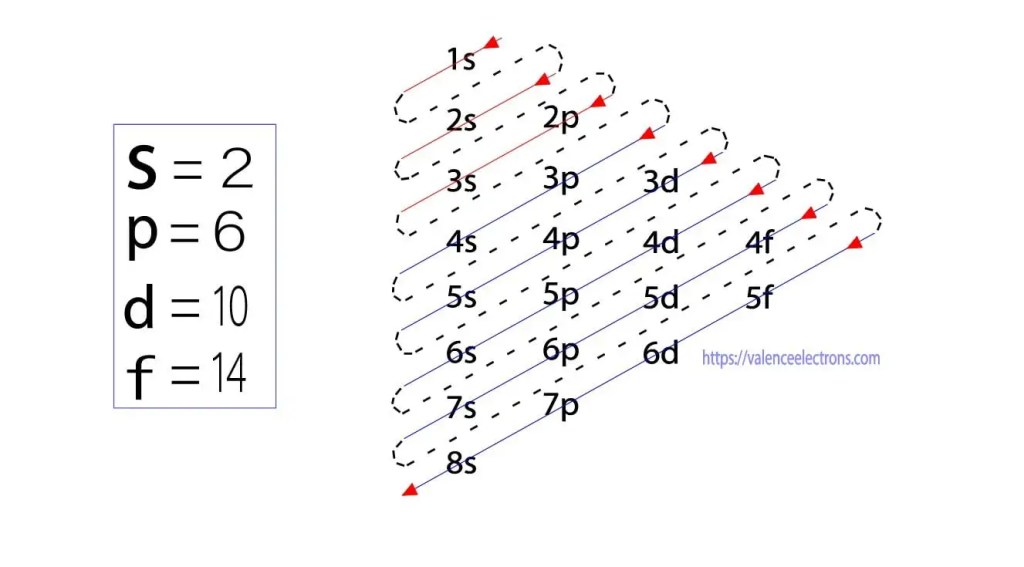
Diese Suborbitale werden durch ‚l‘ ausgedrückt. Das Aufbauprinzip besteht darin, dass die im Atom vorhandenen Elektronen zuerst das Orbital mit der niedrigsten Energie vervollständigen und dann allmählich das Orbital mit der höheren Energie vervollständigen. Diese Orbitale heißen s, p, d, f. Die Elektronenhaltekapazität dieser Orbitale beträgt s = 2, p = 6, d = 10 und f = 14.
Valenzelektronen können jedoch leicht identifiziert werden, indem Elektronen nach dem Bohr-Prinzip angeordnet werden. Jetzt werden wir lernen, wie man das Valenzelektron von Arsen(As) bestimmt.
Schritt 1: Bestimmung der Gesamtzahl der Elektronen in Arsen (As)
1. Wir müssen die Gesamtzahl der Elektronen im Arsenatom kennen. Um die Anzahl der Elektronen zu kennen, müssen Sie die Anzahl der Protonen in Arsen kennen. Und um die Anzahl der Protonen zu kennen, müssen Sie die Ordnungszahl des Arsenelements kennen.
Um die Ordnungszahl zu kennen, brauchen wir die Hilfe eines Periodensystems. Es ist notwendig, die Ordnungszahl von Arsen(As) -Elementen aus dem Periodensystem zu kennen. Die Ordnungszahl ist die Anzahl der Protonen. Und Elektronen, die Protonen gleich sind, befinden sich außerhalb des Kerns.

Das heißt, wir können endlich sagen, dass es Elektronen gibt, die der Ordnungszahl im Arsenatom entsprechen. Aus dem Periodensystem sehen wir, dass die Ordnungszahl von Arsen(As) 33 ist. Das heißt, das Arsenatom hat insgesamt dreiunddreißig Elektronen.
Schritt-2: Tun müssen elektron konfiguration von arsen
Schritt-2 ist sehr wichtig. In diesem Schritt müssen die Elektronen von Arsen angeordnet werden. Wir wissen, dass Arsen (As) -Atome insgesamt dreiunddreißig Elektronen haben. Die Elektronenkonfiguration des Arsens zeigt, dass sich zwei Elektronen in der K-Schale befinden, acht in der L-Schale, achtzehn in der M-Schale und fünf in der N-Schale (Umlaufbahn).

Das heißt, die erste Schale aus Arsen hat zwei Elektronen, die zweite Schale hat acht Elektronen, die 3. Schale hat achtzehn Elektronen und die 4. Schale(letzte Umlaufbahn) hat fünf Elektronen. Die Anzahl der Elektronen pro Schale von Arsen(As) beträgt 2, 8, 18, 5. Die Elektronenkonfiguration von Arsen durch die Unterbahn ist 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3.
Schritt-3: Bestimmen Sie die Valenzschale und berechnen Sie die Gesamtelektronen
Der dritte Schritt besteht darin, die Valenzschale zu diagnostizieren. Die letzte Schale nach der Elektronenkonfiguration wird Valenzschale(Orbit) genannt. Die Gesamtzahl der Elektronen in einer Valenzschale wird als Valenzelektron bezeichnet. Die Elektronenkonfiguration von Arsen (As) zeigt, dass die letzte Schale von Arsen fünf Elektronen hat. Daher haben Arsenatome 5 Valenzelektronen.
Wie viele Valenzelektronen hat das Arsenion(As3-)?
Die Elemente, die 5, 6 oder sieben Elektronen in der letzten Schale (Umlaufbahn) haben, erhalten die Elektronen in der letzten Schale während der Bindungsbildung. Die Elemente, die Elektronen empfangen und Bindungen bilden, werden Anionen genannt. Das heißt, Arsen(As) ist ein Anionenelement.
As + 3e- → As3-
Während der Bildung von Arsenverbindungen empfängt die letzte Hülle Elektronen und wandelt sie in Arsenionen um(As3-). Die Elektronenkonfiguration von Arsenionen (As3-) ist 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6.
Die Elektronenkonfiguration von Arsenionen zeigt, dass Arsenionen (As3-) vier Schalen haben und die letzte Schale acht Elektronen (4s2 4p6). Die Elektronenkonfiguration zeigt, dass das Arsenatom die Elektronenkonfiguration von Krypton angenommen hat. Da die letzte Schale eines Arsenions acht Elektronen hat, sind die Valenzelektronen von Arsenionen (As3-) acht.
Was ist die Wertigkeit von Arsen?
Die Fähigkeit eines Atoms eines Elements, sich während der Bildung eines Moleküls mit einem anderen Atom zu verbinden, wird Valenz (Valenz) genannt. Die Anzahl der ungepaarten Elektronen in der letzten Umlaufbahn eines Elements ist die Wertigkeit dieses Elements. In der Elektronenkonfiguration für Arsen (As) sehen wir, dass fünf Elektronen in der letzten Schale des Arsens existieren. Daher ist die Wertigkeit des Arsen (As) 5.

Wiederum wird die Valenz aus der Elektronenkonfiguration des Elements im angeregten Zustand bestimmt. Die Elektronenkonfiguration von Arsen im angeregten Zustand ist As * (33) = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4px1 4py1 4pz1. Hier zeigt die Elektronenkonfiguration von Arsen, dass drei ungepaarte Elektronen in der letzten Schale existieren. In diesem Fall beträgt die Wertigkeit des Arsenatoms 3.
Die Oxidationsstufen von Arsen hängen von der Bindungsbildung ab. Die Oxidationsstufe von Arsen beträgt +3. Die Oxidationsstufe von Arsen + 3 wurde in Galliumarsenid (GaAs) verwendet. Die Wertigkeit von Arsen in dieser Verbindung beträgt 3.