det 33. elementet i det periodiske bordet er arsen. Elementet i gruppe-15 er arsen og dets symbol er ‘As’. Arsen danner bindinger gjennom sine valenselektroner. Denne artikkelen diskuterer i detalj valenselektronene av arsen. Forhåpentligvis, etter å ha lest denne artikkelen vil du vite i detalj om arsen (As) valenselektroner.
Innholdsfortegnelse
- Hvor mange elektroner og protoner har arsen?
- Hva er valenselektronene av arsen(As)?
- hvordan beregner du antall valenselektroner i et arsenatom?
- Trinn-1: Bestemme totalt antall elektroner i arsen (As)
- Trinn-2: Trenger å gjøre elektronkonfigurasjon av arsen
- Trinn-3: Bestem valensskallet og beregne totale elektroner
- Hvor mange valenselektroner har arsen ion(As3 -)?
- Hva er valensen av arsen?
Hvor mange elektroner og protoner har arsen?
kjernen ligger i sentrum av atomet. Protoner og nøytroner befinner seg i kjernen. Atomnummeret til arsen(As) er 33. Atomnummeret er antall protoner.
det vil si at antall protoner i arsen er trettitre. Elektroner lik protoner er plassert i et sirkulært skall utenfor kjernen. Det vil si at et arsenatom har totalt trettito elektroner.
Hva er valenselektronene av arsen(As)?
det totale antall elektroner i det siste skallet etter elektronkonfigurasjonen av arsen kalles valenselektronene av arsen. Valenselektronen er det totale antall elektroner i siste bane (skall).

valenselektronene bestemmer egenskapene til elementet og deltar i dannelsen av bindinger. Det 33. elementet i det periodiske bordet er arsen (As). Det vil si at atomet i arsenelementet har totalt trettito elektroner.
elektronkonfigurasjonen av arsen viser at det siste skallet av arsen har totalt fem elektroner. Det vil si, vi kan lett si at valenselektronene av arsen er fem. Det er en artikkel på dette nettstedet som beskriver elektronkonfigurasjonen av arsen, du kan lese den hvis du vil.
hvordan beregner du antall valenselektroner i et arsenatom?
Nå vil Vi vite hvordan du enkelt kan bestemme valenselektronene av arsen. Valenselektronen må bestemmes ved å følge noen få trinn. Elektronkonfigurasjonen er en av dem. Det er ikke mulig å bestemme valenselektronen uten elektronkonfigurasjon.
Å Vite elektronkonfigurasjonen på riktig måte, er det veldig enkelt å bestemme valenselektronene til alle elementene. Det er en artikkel publisert på dette nettstedet som beskriver elektronkonfigurasjonen, du kan lese den hvis du vil. Denne artikkelen diskuterer imidlertid kort elektronkonfigurasjon.
Forsker Niels Bohr var den første som ga en ide om atomets bane(skall). Han ga en modell av atomet i 1913. Den komplette ideen om bane er gitt der. Atomets elektroner dreier seg rundt kjernen i en bestemt sirkulær bane. Disse sirkulære banene kalles bane (skall). Disse banene er uttrykt med n.
K er navnet på den første bane(skall), L er den andre, M er den tredje, N er navnet på det fjerde skallet. Elektronholdingskapasiteten til hver bane er 2n2.
Nå,
- n = 1 For K bane.
elektronholdingskapasiteten Til K-bane er 2n2 = 2 × 12 = 2 elektroner. - for L bane, n = 2.
elektronholdingskapasiteten Til l-bane er 2n2 = 2 × 22 = 8 elektroner. - n=3 for M bane.
maksimal elektronholdingskapasitet I M bane er 2n2 = 2 × 32 = 18 elektroner. - n = 4 for N bane.
maksimal elektronholdingskapasitet I N bane er 2n2 = 2 × 42 = 32 elektroner.
i tillegg til denne metoden kan elektronkonfigurasjon gjøres gjennom underbaner. Den tyske fysikeren aufbau foreslo først en ide om elektronkonfigurasjon gjennom underbaner. Aufbau-metoden er å gjøre elektronkonfigurasjon gjennom sub-energinivået.
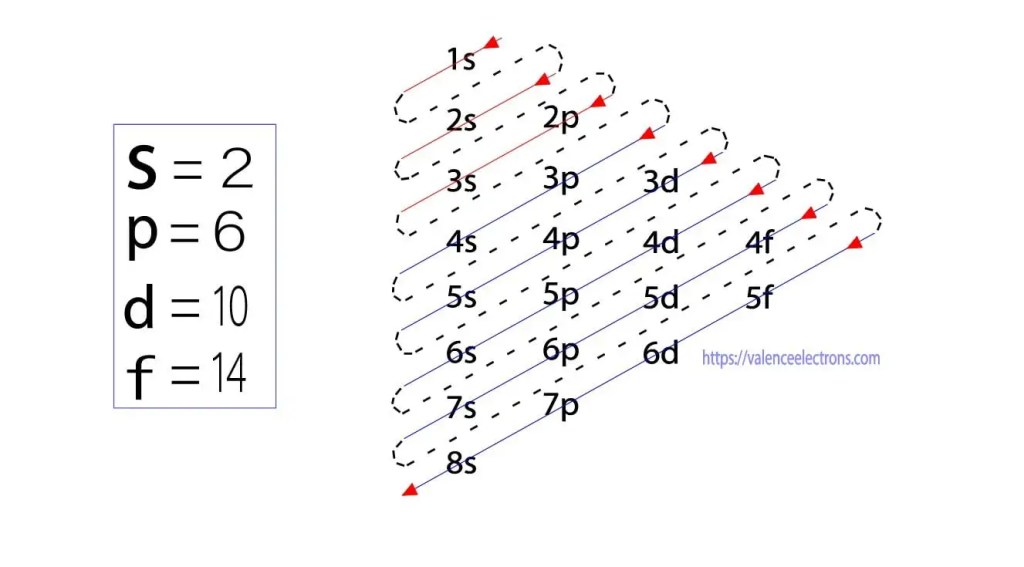
disse sub-orbitaler er uttrykt av ‘l’. Aufbau-prinsippet er at elektronene som er tilstede i atomet, først vil fullføre den laveste energi-orbitalen og deretter gradvis fortsette å fullføre den høyere energi-orbitalen. Disse orbitalene heter s, p, d, f. elektronholdingskapasiteten til disse orbitalene er s = 2, p = 6, d = 10 og f = 14.
valenselektroner kan imidlertid lett identifiseres ved å arrangere elektroner i Henhold Til Bohr-prinsippet. Nå skal vi lære å bestemme valenselektronen av arsen (As).
Trinn-1: Bestemme totalt antall elektroner i arsen (As)
1. vi trenger å vite totalt antall elektroner i arsenatomet. For å vite antall elektroner må du vite antall protoner i arsen. Og for å vite antall protoner, må du vite atomnummeret til arsenelementet.
for å vite atomnummeret må vi ta hjelp av et periodisk bord. Det er nødvendig å kjenne atomnummeret av arsen (As) elementer fra det periodiske bordet. Atomnummeret er antall protoner. Og elektroner lik protoner er plassert utenfor kjernen.

Det vil si, vi kan endelig si at det er elektroner lik atomnummeret i arsenatomet. Fra det periodiske bordet ser vi at atomnummeret arsen (As) er 33. Det vil si at arsenatomet har totalt trettito elektroner.
Trinn-2: Trenger å gjøre elektronkonfigurasjon av arsen
Step-2 er veldig viktig. I dette trinnet må elektronene av arsen ordnes. Vi vet at arsen (As) atomer har totalt trettitre elektroner. Elektronkonfigurasjonen av arsen viser at det er to elektroner I k-skallet, åtte i l-skallet, atten I m-skallet og fem i n-skallet(bane).

Det vil si at det første skallet av arsen har to elektroner, det andre skallet har åtte elektroner, 3. skallet har atten elektroner og 4. skallet (siste bane) har fem elektroner. Antall elektroner per skall av arsen (As) er 2, 8, 18, 5. Elektronkonfigurasjonen av arsen gjennom underbanen er 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3.
Trinn-3: Bestem valensskallet og beregne totale elektroner
det tredje trinnet er å diagnostisere valensskallet. Det siste skallet etter elektronkonfigurasjonen kalles valensskallet (bane). Det totale antall elektroner i et valensskall kalles et valenselektron. Elektronkonfigurasjonen av arsen (As) viser at det siste skallet av arsen har fem elektroner. Derfor har arsenatomer 5 valenselektroner.
Hvor mange valenselektroner har arsen ion(As3 -)?
elementene som har 5, 6 eller syv elektroner i det siste skallet(bane) mottar elektronene i det siste skallet under bindingsdannelse. Elementene som mottar elektroner og danner bindinger kalles anioner. Det vil si at arsen (As) er et anionelement.
As + 3e- → As3 –
under dannelsen av arsenbindinger mottar det siste skallet elektroner og gjør dem til arsenioner(As3 -). Elektronkonfigurasjonen av arsen ioner (As3 -) er 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6.
elektronkonfigurasjonen av arsenioner viser at arsenioner(As3-) har fire skall og det siste skallet har åtte elektroner (4s2 4p6). Elektronkonfigurasjonen viser at arsenatomet har fått elektronkonfigurasjonen til krypton. Siden det siste skallet i et arsenion har åtte elektroner, er valenselektronene av arsenioner(As3-) åtte.
Hva er valensen av arsen?
evnen til et atom av et element til å bli med i et annet atom under dannelsen av et molekyl kalles valens (valens). Antallet uparede elektroner i den siste bane av et element er valensen av det elementet. I elektronkonfigurasjonen for arsen (As) ser vi at fem elektroner eksisterer i arsenets siste skall. Derfor er valensen av arsen (As) 5.

Igjen bestemmes Valens fra elektronkonfigurasjonen av elementet i eksitert tilstand. Elektronkonfigurasjonen av arsen i opphisset tilstand Er As*(33) = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4px1 4py1 4pz1. Her viser elektronkonfigurasjonen av arsen at tre uparede elektroner eksisterer i det siste skallet. I dette tilfellet er valensen av arsenatomet 3.
oksidasjonstilstandene av arsen er avhengig av bindingsdannelsen. Oksidasjonstilstanden til arsen er +3. Oksidasjonstilstanden til arsen + 3 har blitt brukt I Galliumarsenid (GaAs). Valensen av arsen i denne forbindelsen er 3.