jaksollisen järjestelmän 33.alkuaine on arseeni. Ryhmän-15 alkuaine on arseeni ja sen tunnus on ”As”. Arseeni muodostaa sidoksia valenssielektroniensa kautta. Tässä artikkelissa käsitellään yksityiskohtaisesti arseenin valenssielektroneja. Toivottavasti, kun olet lukenut tämän artikkelin tiedät yksityiskohtaisesti arseenin (As) valenssi elektronit.
Sisällysluettelo
- kuinka monta elektronia ja protonia arseenilla on?
- mitkä ovat arseenin(As) valenssielektronit?
- miten arseeniatomin valenssielektronien lukumäärä lasketaan?
- Vaihe 1: arseenin(As) elektronien kokonaismäärän määrittäminen
- Vaihe 2: Tarve tehdä arseenin elektronikonfiguraatio
- Vaihe 3: Määritetään valenssikuori ja lasketaan kokonaiselektronit
- kuinka monta valenssielektronia arseeni-ionilla (As3 -) on?
- mikä on arseenin valenssi?
kuinka monta elektronia ja protonia arseenilla on?
ydin sijaitsee atomin keskellä. Protonit ja neutronit sijaitsevat ytimessä. Arseenin(As) järjestysluku on 33. Järjestysluku on protonien lukumäärä.
toisin sanoen arseenin protonien lukumäärä on kolmekymmentäkolme. Protonien veroiset elektronit sijaitsevat ympyrän muotoisessa kuoressa ytimen ulkopuolella. Toisin sanoen arseeniatomilla on yhteensä kolmekymmentäkolme elektronia.
mitkä ovat arseenin(As) valenssielektronit?
viimeisen kuoren elektronien kokonaismäärää arseenin elektronikonfiguraation jälkeen kutsutaan arseenin valenssielektroneiksi. Valenssielektroni on elektronien kokonaismäärä viimeisellä kiertoradalla (shell).

valenssielektronit määrittävät alkuaineen ominaisuudet ja osallistuvat sidosten muodostumiseen. Jaksollisen järjestelmän 33. alkuaine on arseeni (As). Toisin sanoen arseenielementin atomilla on yhteensä kolmekymmentäkolme elektronia.
arseenin elektronikonfiguraatio osoittaa, että arseenin viimeisessä kuoressa on yhteensä viisi elektronia. Toisin sanoen voimme helposti sanoa, että arseenin valenssielektroneja on viisi. On artikkeli tällä sivustolla yksityiskohtaisesti elektronikonfiguraatio arseenin, voit lukea sen, jos haluat.
miten arseeniatomin valenssielektronien lukumäärä lasketaan?
nyt tiedämme, miten arseenin valenssielektronit voidaan helposti määrittää. Valenssielektroni on määritettävä muutaman vaiheen avulla. Elektronikonfiguraatio on yksi niistä. Valenssielektronia ei ole mahdollista määrittää ilman elektronikonfiguraatiota.
kun tunnetaan elektronikonfiguraatio oikealla tavalla, on hyvin helppo määrittää kaikkien alkuaineiden valenssielektronit. On artikkeli julkaistu tällä sivustolla yksityiskohtaisesti electron kokoonpano, voit lukea sen, jos haluat. Tässä artikkelissa käsitellään kuitenkin lyhyesti elektronikonfiguraatiota.
tiedemies Niels Bohr esitti ensimmäisenä ajatuksen atomin kiertoradasta(kuoresta). Hän antoi mallin atomin vuonna 1913. Täydellinen käsitys kiertoradasta annetaan siellä. Atomin elektronit kiertävät ydintä tietyllä ympyräradalla. Näitä ympyräratoja kutsutaan kiertoradaksi (shell). Nämä kiertoradat ilmaistaan n: llä.
K on ensimmäisen radan nimi (kuori), L on toinen, M on kolmas, N on neljännen kuoren nimi. Elektronien pitokyky kullakin kiertoradalla on 2N2.
nyt,
- N = 1 K-kiertoradalla.
k-kiertoradan elektronien pitokyky on 2N2 = 2 × 12 = 2 elektronia. - l-kiertoradalla, n = 2.
l-radan elektronien pitokyky on 2N2 = 2 × 22 = 8 elektronia. - N = 3 m-kiertoradalla.
suurin elektronien pitokyky m-kiertoradalla on 2N2 = 2 × 32 = 18 elektronia. - N = 4 n-kiertoradalla.
suurin elektronien pitokyky n-kiertoradalla on 2N2 = 2 × 42 = 32 elektronia.
tämän menetelmän lisäksi elektronikonfiguraatio voidaan tehdä aliorbitaalien kautta. Saksalainen fyysikko Aufbau esitti ensimmäisenä ajatuksen elektronikonfiguraatiosta aliorbitaalien kautta. Aufbau-menetelmässä elektronikonfiguraatio tehdään alienergiatason kautta.
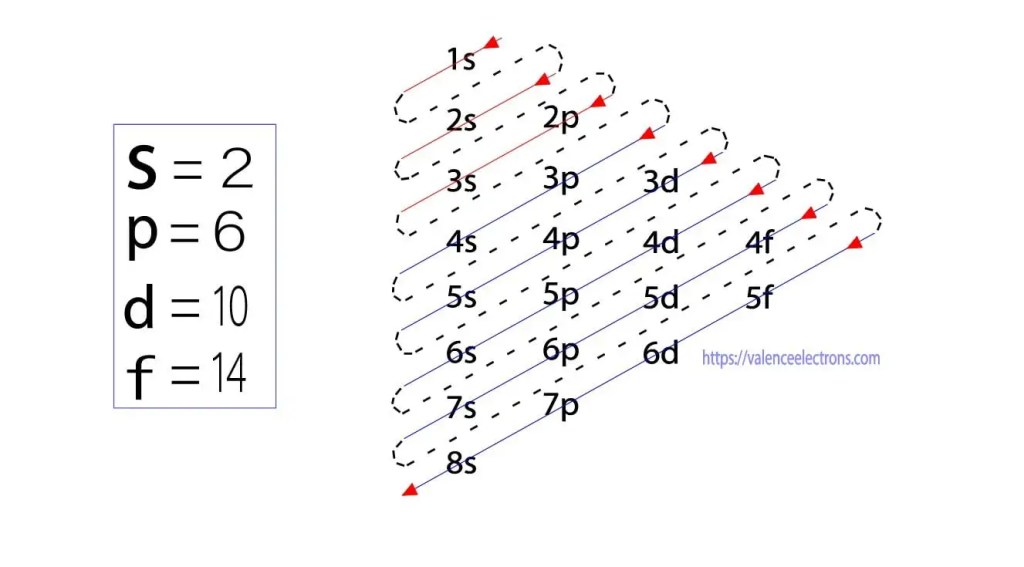
nämä osaorbitaalit ilmaistaan ”l”: llä. Aufbau-periaate on, että atomissa olevat elektronit täyttävät ensin matalaenergiaisen orbitaalin ja jatkavat sitten vähitellen korkeamman energian orbitaalin täydentämistä. Näiden orbitaalien nimet ovat S, p, d, f. näiden orbitaalien elektronien pitokyky on S = 2, p = 6, d = 10 ja f = 14.
valenssielektronit voidaan kuitenkin helposti tunnistaa järjestelemällä elektroneja Bohr-periaatteen mukaisesti. Nyt opimme määrittämään arseenin valenssielektronia (As).
Vaihe 1: arseenin(As) elektronien kokonaismäärän määrittäminen
1.Meidän on tiedettävä arseeniatomin elektronien kokonaismäärä. Jotta tietää elektronien määrän, pitää tietää arseenin sisältämien protonien määrä. Jotta tietää protonien määrän, pitää tietää arseenielementin järjestysluku.
jotta tietäisimme järjestysluvun, meidän on käytettävä jaksollisen järjestelmän apua. On tarpeen tietää arseenin(As) alkuaineiden järjestysluku jaksollisesta järjestelmästä. Järjestysluku on protonien lukumäärä. Ja protonien veroiset elektronit sijaitsevat ytimen ulkopuolella.

toisin sanoen voimme lopulta sanoa, että on olemassa elektroneja, jotka vastaavat arseeniatomin järjestyslukua. Jaksollisesta järjestelmästä näemme, että arseenin(As) järjestysluku on 33. Toisin sanoen arseeniatomilla on yhteensä kolmekymmentäkolme elektronia.
Vaihe 2: Tarve tehdä arseenin elektronikonfiguraatio
Vaihe 2 on erittäin tärkeä. Tässä vaiheessa arseenin elektronit on järjestettävä. Tiedämme, että arseenin(As) atomeilla on yhteensä kolmekymmentäkolme elektronia. Arseenin elektronikonfiguraatio osoittaa, että K-kuoressa on kaksi elektronia, l-kuoressa kahdeksan, m-kuoressa kahdeksantoista ja n-kuoressa(kiertoradalla) viisi.

toisin sanoen arseenin ensimmäisellä kuorella on kaksi elektronia, toisella kuorella kahdeksan elektronia, 3.kuorella kahdeksantoista elektronia ja 4. kuorella(viimeisellä kiertoradalla) viisi elektronia. Arseenin(As) elektronien määrä kuorta kohti on 2, 8, 18, 5. Arseenin elektronikonfiguraatio aliradan läpi on 1s2 2s2 2P6 3s2 3p6 4S2 3d10 4P3.
Vaihe 3: Määritetään valenssikuori ja lasketaan kokonaiselektronit
kolmas vaihe on valenssikuoren diagnosointi. Elektronikonfiguraation jälkeistä viimeistä kuorta kutsutaan valenssikuoreksi (kiertoradaksi). Valenssikuoren elektronien kokonaismäärää kutsutaan valenssielektroniksi. Arseenin elektronikonfiguraatio (As) osoittaa, että arseenin viimeisellä kuorella on viisi elektronia. Näin ollen arseeniatomeilla on 5 valenssielektronia.
kuinka monta valenssielektronia arseeni-ionilla (As3 -) on?
ne alkuaineet, joilla on 5, 6 tai seitsemän elektronia viimeisellä kuorella(kiertoradalla), saavat viimeisen kuoren elektronit sidoksen muodostuessa. Elektroneja vastaanottavia ja sidoksia muodostavia alkuaineita kutsutaan anioneiksi. Toisin sanoen arseeni(As) on anionielementti.
As + 3e– → As3-
arseenisidosten muodostuessa viimeinen kuori vastaanottaa elektroneja ja muuttaa ne arseeni-ioneiksi(As3 -). Arseeni-ionien elektronikonfiguraatio (As3 -) on 1s2 2s2 2P6 3s2 3p6 4S2 3d10 4P6.
arseeni-ionien elektronikonfiguraatio osoittaa, että arseeni-ioneilla(As3 -) on neljä kuorta ja viimeisellä kuorella kahdeksan elektronia(4s2 4p6). Elektronikonfiguraatio osoittaa, että arseeniatomi on saanut Kryptonin elektronikonfiguraation. Koska arseeni-ionin viimeisessä kuoressa on kahdeksan elektronia, arseeni-ionien(As3 -) valenssielektroneja on kahdeksan.
mikä on arseenin valenssi?
alkuaineen yhden atomin kykyä liittyä toiseen atomiin molekyylin muodostuessa kutsutaan valenssiksi (valenssiksi). Alkuaineen viimeisellä kiertoradalla olevien parittomien elektronien lukumäärä on kyseisen alkuaineen valenssi. Arseenin elektronikonfiguraatiossa (As) näemme, että arseenin viimeisessä kuoressa on viisi elektronia. Näin ollen arseenin(As) valenssi on 5.

jälleen valenssi määritetään alkuaineen elektronikonfiguraatiosta viritetyssä tilassa. Arseenin elektronikonfiguraatio virittyneessä tilassa on As*(33) = 1s2 2s2 2P6 3s2 3p6 4S2 3d10 4px1 4py1 4pz1. Tässä arseenin elektronikonfiguraatio osoittaa, että viimeisessä kuoressa on kolme paritonta elektronia. Tällöin arseeniatomin valenssi on 3.
arseenin hapetustilat riippuvat sidoksen muodostumisesta. Arseenin hapetustila on +3. Arseenin hapetustilaa +3 on käytetty Galliumarsenidissa (GaAs). Arseenin valenssi tässä yhdisteessä on 3.