het 33e element van het periodiek systeem is arseen. Het element van groep-15 is arseen en het symbool is ‘As’. Arseen vormt bindingen door zijn valentie-elektronen. Dit artikel bespreekt in detail de valentie-elektronen van arseen. Hopelijk, na het lezen van dit artikel zult u in detail weten over de arseen(As) valentie elektronen.
inhoudsopgave:
- hoeveel elektronen en protonen heeft arseen?
- Wat zijn de valentie-elektronen van arseen (As)?
- hoe bereken je het aantal valentie-elektronen in een arseenatoom?
- Stap 1: Bepaling van het totale aantal elektronen in arseen(As)
- Stap 2: De behoefte aan elektronenconfiguratie van arseen
- Stap 3: Bepaal de valentieschil en bereken de totale elektronen
- hoeveel valentie-elektronen heeft arseen-ion(As3 -)?
- Wat is de valentie van arseen?
hoeveel elektronen en protonen heeft arseen?
de kern bevindt zich in het midden van het atoom. Protonen en neutronen bevinden zich in de kern. Het atoomnummer van arseen (As) is 33. Het atoomnummer is het aantal protonen.
het aantal protonen in arseen is drieëndertig. Elektronen gelijk aan protonen bevinden zich in een cirkelvormige schil buiten de kern. Dat wil zeggen, een arseenatoom heeft in totaal drieëndertig elektronen.
Wat zijn de valentie-elektronen van arseen (As)?
het totale aantal elektronen in de laatste schil na de elektronenconfiguratie van arseen wordt de valentie-elektronen van arseen genoemd. Het valentie-elektron is het totale aantal elektronen in de laatste baan(shell).

de valentie-elektronen bepalen de eigenschappen van het element en nemen deel aan de vorming van bindingen. Het 33e element in het periodiek systeem is arseen (As). Dat wil zeggen, het atoom van het arseenelement heeft in totaal drieëndertig elektronen.De elektronenconfiguratie van arseen toont aan dat de laatste schil van arseen in totaal vijf elektronen heeft. Dat wil zeggen, we kunnen gemakkelijk zeggen dat de valentie-elektronen van arseen vijf zijn. Er is een artikel op deze site over de elektronenconfiguratie van arseen, je kunt het lezen als je wilt.
hoe bereken je het aantal valentie-elektronen in een arseenatoom?
nu zullen we weten hoe we de valentie-elektronen van arseen eenvoudig kunnen bepalen. De valentie elektron moet worden bepaald door het volgen van een paar stappen. De elektronenconfiguratie is er een van. Het is niet mogelijk om het valentie-elektron te bepalen zonder elektronenconfiguratie.
door de elektronenconfiguratie op de juiste manier te kennen, is het heel gemakkelijk om de valentie-elektronen van alle elementen te bepalen. Er is een artikel gepubliceerd op deze site over de elektronenconfiguratie, je kunt het lezen als je wilt. In dit artikel wordt echter kort ingegaan op de elektronenconfiguratie.Wetenschapper Niels Bohr was de eerste die een idee gaf van de baan van het atoom(shell). Hij leverde een model van het atoom in 1913. Het volledige idee van de baan wordt hier gegeven. De elektronen van het atoom draaien rond de kern in een bepaald cirkelvormig pad. Deze cirkelvormige paden worden orbit(shell) genoemd. Deze banen worden uitgedrukt door n.
K is de naam van de eerste baan(shell), L is de tweede, M is de derde, N is de naam van de vierde shell. De elektronenhoudcapaciteit van elke baan is 2n2.
nu,
- n = 1 voor een K-Baan.
de elektronenhoudcapaciteit van een K-baan is 2n2 = 2 × 12 = 2 elektronen. - Voor l-Baan, n = 2.
de elektronenhoudcapaciteit van de l-baan is 2n2 = 2 × 22 = 8 elektronen. - n = 3 voor m-Baan.
de maximale elektronenhoudcapaciteit in een baan om M is 2n2 = 2 × 32 = 18 elektronen. - n = 4 voor n-baan.
de maximale elektronenhoudcapaciteit in n-baan is 2n2 = 2 × 42 = 32 elektronen.
naast deze methode kan de elektronenconfiguratie worden uitgevoerd via subbanen. De Duitse natuurkundige Aufbau stelde voor het eerst een idee voor van elektronenconfiguratie door middel van subbanen. De Aufbau methode is om elektronenconfiguratie door het sub-energieniveau te doen.
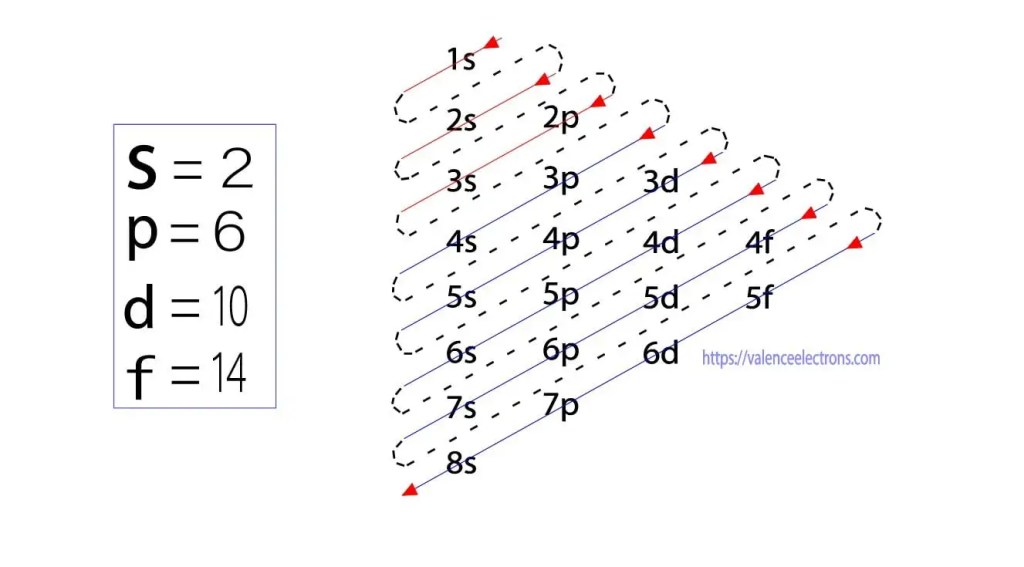
deze sub-orbitalen worden uitgedrukt door ‘l’. Het Aufbau principe is dat de elektronen die aanwezig zijn in het atoom eerst de laagste energiebaan zullen voltooien en dan geleidelijk verder zullen gaan met de hogere energiebaan. Deze orbitalen worden s, p, d, f genoemd. de elektronenhoudcapaciteit van deze orbitalen is s = 2, p = 6, d = 10 en f = 14.Valentie-elektronen kunnen echter gemakkelijk worden geïdentificeerd door elektronen te rangschikken volgens het Bohr-Principe. Nu leren we hoe we het valentie-elektron van arseen(As) kunnen bepalen.
Stap 1: Bepaling van het totale aantal elektronen in arseen(As)
1ste we moeten het totale aantal elektronen in het arseenatoom weten. Om het aantal elektronen te weten, moet je het aantal protonen in arseen weten. En om het aantal protonen te weten, moet je het atoomnummer van het arseenelement kennen.
om het atoomnummer te kennen moeten we gebruik maken van een periodiek systeem. Het is noodzakelijk om het atoomnummer van arseen(As) elementen uit het periodiek systeem te kennen. Het atoomnummer is het aantal protonen. Elektronen gelijk aan protonen bevinden zich buiten de kern.

dat wil zeggen, we kunnen eindelijk zeggen dat er elektronen zijn gelijk aan het atoomnummer in het arseenatoom. Uit het periodiek systeem zien we dat het atoomnummer van arseen(As) 33 is. Dat wil zeggen, het arseenatoom heeft in totaal drieëndertig elektronen.
Stap 2: De behoefte aan elektronenconfiguratie van arseen
Stap 2 is zeer belangrijk. In deze stap moeten de elektronen van arseen worden gerangschikt. We weten dat arseen (As) atomen in totaal drieëndertig elektronen hebben. De elektronenconfiguratie van arseen laat zien dat er twee elektronen in de k-schil zitten, acht in de L-schil, achttien in de M-schil en vijf in de n-schil(Baan).

dat wil zeggen, de eerste schil van arseen heeft twee elektronen, de tweede schil heeft acht elektronen, de derde schil heeft achttien elektronen en de vierde schil(laatste baan) heeft vijf elektronen. Het aantal elektronen per schil van arseen (As) is 2, 8, 18, 5. De elektronenconfiguratie van arseen door de subbaan is 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3.
Stap 3: Bepaal de valentieschil en bereken de totale elektronen
de derde stap is het diagnosticeren van de valentieschil. De laatste schil na de elektronenconfiguratie wordt de valentieschelp(orbit) genoemd. Het totale aantal elektronen in een valentieschil wordt een valentie-elektron genoemd. De elektronenconfiguratie van arseen(As) laat zien dat de laatste schil van arseen vijf elektronen heeft. Daarom hebben arseenatomen 5 valentie-elektronen.
hoeveel valentie-elektronen heeft arseen-ion(As3 -)?
de elementen die 5, 6 of 7 elektronen hebben in de laatste schil(Baan) ontvangen de elektronen in de laatste schil tijdens de bindingsvorming. De elementen die elektronen ontvangen en bindingen vormen worden anionen genoemd. Dat wil zeggen, arseen (As) is een anion element.
As + 3e – → As3 –
tijdens de vorming van arseenbindingen ontvangt de laatste schil elektronen en verandert deze in arseenionen(As3-). De elektronenconfiguratie van arseenionen (As3 -) is 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6.De elektronenconfiguratie van arseenionen toont aan dat arseenionen(As3-) vier schalen hebben en de laatste schil acht elektronen(4s2 4p6). De elektronenconfiguratie toont aan dat het arseenatoom de elektronenconfiguratie van krypton heeft verkregen. Aangezien de laatste schil van een arseen-ion acht elektronen heeft, zijn de valentie-elektronen van arseen-ionen(As3 -) acht.
Wat is de valentie van arseen?
het vermogen van een atoom van een element om zich bij een ander atoom aan te sluiten tijdens de vorming van een molecuul wordt valentie (valentie) genoemd. Het aantal ongepaarde elektronen in de laatste baan van een element is de valentie van dat element. In de elektronenconfiguratie voor arseen (As) zien we dat er vijf elektronen bestaan in de laatste schil van het arseen. Daarom is de valentie van arseen(As) 5.

ook hier wordt valentie bepaald uit de elektronenconfiguratie van het element in de opgewekte toestand. De elektronenconfiguratie van arseen in opgewonden toestand is As*(33) = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4px1 4py1 4pz1. Hier, de elektronenconfiguratie van arseen laat zien dat er drie ongepaarde elektronen bestaan in de laatste schil. In dit geval is de valentie van het arseenatoom 3.
de oxidatietoestanden van arseen zijn afhankelijk van de bindingsvorming. De oxidatietoestand van arseen is +3. De oxidatietoestand van arseen +3 is gebruikt in galliumarsenide (gaas). De valentie van arseen in deze verbinding is 3.