Le 33ème élément du tableau périodique est l’arsenic. L’élément du groupe-15 est l’arsenic et son symbole est « As ». L’arsenic forme des liaisons à travers ses électrons de valence. Cet article traite en détail des électrons de valence de l’arsenic. Espérons qu’après avoir lu cet article, vous connaîtrez en détail les électrons de valence de l’arsenic (As).
Table des Matières
- Combien d’électrons et de protons l’arsenic a-t-il?
- Quels sont les électrons de valence de l’arsenic (As) ?
- Comment calculez-vous le nombre d’électrons de valence dans un atome d’arsenic?
- Étape 1: Détermination du nombre total d’électrons dans l’arsenic (As)
- Étape-2: Besoin de faire la configuration électronique de l’arsenic
- Étape 3: Déterminer la coquille de valence et calculer les électrons totaux
- Combien d’électrons de valence l’ion arsenic (As3-) a-t-il?
- Quelle est la valence de l’arsenic?
Combien d’électrons et de protons l’arsenic a-t-il?
Le noyau est situé au centre de l’atome. Les protons et les neutrons sont situés dans le noyau. Le numéro atomique de l’arsenic (As) est 33. Le numéro atomique est le nombre de protons.
C’est-à-dire que le nombre de protons dans l’arsenic est de trente-trois. Les électrons égaux aux protons sont situés dans une enveloppe circulaire à l’extérieur du noyau. Autrement dit, un atome d’arsenic a un total de trente-trois électrons.
Quels sont les électrons de valence de l’arsenic (As) ?
Le nombre total d’électrons dans la dernière coquille après la configuration électronique de l’arsenic est appelé électrons de valence de l’arsenic. L’électron de valence est le nombre total d’électrons dans la dernière orbite (coquille).

Les électrons de valence déterminent les propriétés de l’élément et participent à la formation des liaisons. Le 33ème élément du tableau périodique est l’arsenic (As). Autrement dit, l’atome de l’élément arsenic a un total de trente-trois électrons.
La configuration électronique de l’arsenic montre que la dernière enveloppe d’arsenic a un total de cinq électrons. Autrement dit, on peut facilement dire que les électrons de valence de l’arsenic sont au nombre de cinq. Il y a un article sur ce site détaillant la configuration électronique de l’arsenic, vous pouvez le lire si vous le souhaitez.
Comment calculez-vous le nombre d’électrons de valence dans un atome d’arsenic?
Maintenant, nous saurons déterminer facilement les électrons de valence de l’arsenic. L’électron de valence doit être déterminé en suivant quelques étapes. La configuration électronique en fait partie. Il n’est pas possible de déterminer l’électron de valence sans configuration électronique.
Connaissant la configuration électronique de la bonne manière, il est très facile de déterminer les électrons de valence de tous les éléments. Il y a un article publié sur ce site détaillant la configuration électronique, vous pouvez le lire si vous le souhaitez. Cependant, cet article traite brièvement de la configuration des électrons.
Le scientifique Niels Bohr a été le premier à donner une idée de l’orbite de l’atome (coquille). Il a fourni un modèle de l’atome en 1913. L’idée complète de l’orbite y est donnée. Les électrons de l’atome tournent autour du noyau dans un certain chemin circulaire. Ces chemins circulaires sont appelés orbite (coquille). Ces orbites sont exprimées par n.
K est le nom de la première orbite (coquille), L est la deuxième, M est la troisième, N est le nom de la quatrième coquille. La capacité de rétention des électrons de chaque orbite est de 2n2.
Maintenant,
- n = 1 pour l’orbite K.
La capacité de rétention des électrons de l’orbite K est de 2n2 = 2 × 12 = 2 électrons. - Pour l’orbite L, n = 2.
La capacité de rétention des électrons de l’orbite L est de 2n2 = 2 × 22 = 8 électrons. - n = 3 pour l’orbite M.
La capacité de rétention d’électrons maximale en orbite M est de 2n2 = 2 × 32 = 18 électrons. - n = 4 pour N orbite.
La capacité de rétention d’électrons maximale en orbite N est de 2n2 = 2 × 42 = 32 électrons.
En plus de cette méthode, la configuration électronique peut être effectuée via des sous-orbites. Le physicien allemand Aufbau a d’abord proposé une idée de configuration électronique à travers des sous-orbites. La méthode Aufbau consiste à effectuer une configuration électronique à travers le niveau de sous-énergie.
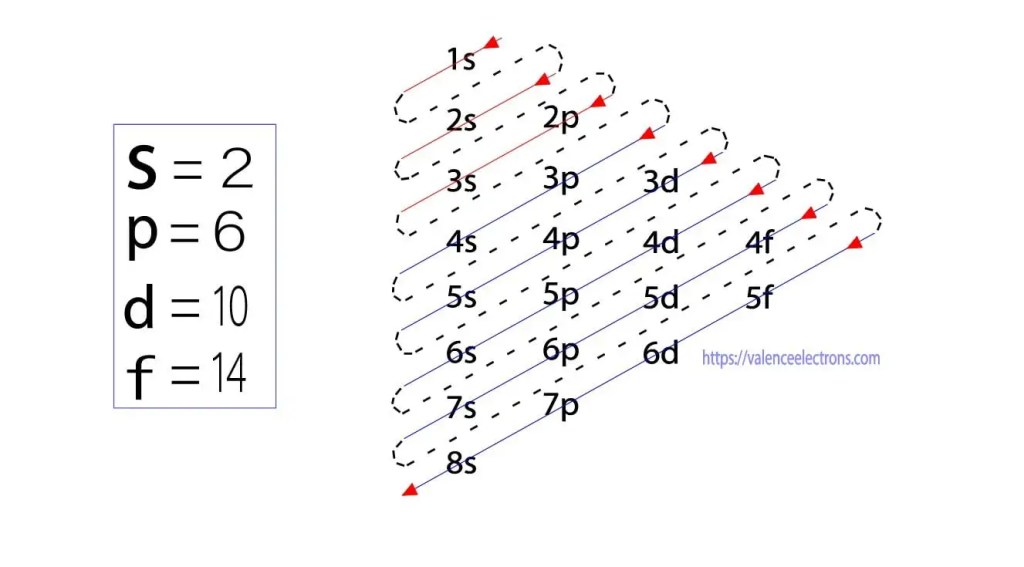
Ces sous-orbitales sont exprimées par » l « . Le principe d’Aufbau est que les électrons présents dans l’atome compléteront d’abord l’orbitale d’énergie la plus basse, puis continueront progressivement à compléter l’orbitale d’énergie la plus élevée. Ces orbitales sont nommées s, p, d, f. La capacité de rétention des électrons de ces orbitales est s = 2, p = 6, d = 10 et f = 14.
Cependant, les électrons de valence peuvent être facilement identifiés en disposant les électrons selon le principe de Bohr. Nous allons maintenant apprendre à déterminer l’électron de valence de l’arsenic (As).
Étape 1: Détermination du nombre total d’électrons dans l’arsenic (As)
1er nous devons connaître le nombre total d’électrons dans l’atome d’arsenic. Pour connaître le nombre d’électrons, vous devez connaître le nombre de protons dans l’arsenic. Et pour connaître le nombre de protons, vous devez connaître le numéro atomique de l’élément arsenic.
Pour connaître le numéro atomique, nous devons utiliser un tableau périodique. Il est nécessaire de connaître le numéro atomique des éléments arsenic (As) du tableau périodique. Le numéro atomique est le nombre de protons. Et les électrons égaux aux protons sont situés à l’extérieur du noyau.

Autrement dit, nous pouvons enfin dire qu’il y a des électrons égaux au numéro atomique dans l’atome d’arsenic. Du tableau périodique, nous voyons que le numéro atomique de l’arsenic (As) est 33. Autrement dit, l’atome d’arsenic a un total de trente-trois électrons.
Étape-2: Besoin de faire la configuration électronique de l’arsenic
L’étape 2 est très importante. Dans cette étape, les électrons de l’arsenic doivent être disposés. Nous savons que les atomes d’arsenic (As) ont un total de trente-trois électrons. La configuration électronique de l’arsenic montre qu’il y a deux électrons dans la coque K, huit dans la coque L, dix-huit dans la coque M et cinq dans la coque N (orbite).

C’est-à-dire que la première coquille d’arsenic a deux électrons, la deuxième coquille a huit électrons, la 3ème coquille a dix-huit électrons et la 4ème coquille (dernière orbite) a cinq électrons. Le nombre d’électrons par enveloppe d’arsenic (As) est de 2, 8, 18, 5. La configuration électronique de l’arsenic à travers la sous-orbite est 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3.
Étape 3: Déterminer la coquille de valence et calculer les électrons totaux
La troisième étape consiste à diagnostiquer la coquille de valence. La dernière coquille après la configuration électronique s’appelle la coquille de valence (orbite). Le nombre total d’électrons dans une coquille de valence est appelé électron de valence. La configuration électronique de l’arsenic (As) montre que la dernière coquille d’arsenic a cinq électrons. Par conséquent, les atomes d’arsenic ont 5 électrons de valence.
Combien d’électrons de valence l’ion arsenic (As3-) a-t-il?
Les éléments qui ont 5, 6 ou sept électrons dans la dernière coquille (orbite) reçoivent les électrons dans la dernière coquille pendant la formation de la liaison. Les éléments qui reçoivent des électrons et forment des liaisons sont appelés anions. C’est-à-dire que l’arsenic (As) est un élément anionique.
As +3e- → As3-
Lors de la formation des liaisons arsenic, la dernière coque reçoit des électrons et les transforme en ions arsenic (As3-). La configuration électronique des ions arsenic (As3-) est 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6.
La configuration électronique des ions arsenic montre que les ions arsenic (As3-) ont quatre coquilles et que la dernière coquille a huit électrons (4s2 4p6). La configuration électronique montre que l’atome d’arsenic a acquis la configuration électronique du krypton. Puisque la dernière enveloppe d’un ion arsenic a huit électrons, les électrons de valence des ions arsenic (As3-) sont huit.
Quelle est la valence de l’arsenic?
La capacité d’un atome d’un élément à rejoindre un autre atome lors de la formation d’une molécule est appelée valence (valence). Le nombre d’électrons non appariés dans la dernière orbite d’un élément est la valence de cet élément. Dans la configuration électronique de l’arsenic (As), nous voyons que cinq électrons existent dans la dernière enveloppe de l’arsenic. Par conséquent, la valence de l’arsenic (As) est de 5.

Là encore, la valence est déterminée à partir de la configuration électronique de l’élément à l’état excité. La configuration électronique de l’arsenic à l’état excité est la suivante: *(33) = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4px1 4py1 4pz1. Ici, la configuration électronique de l’arsenic montre qu’il existe trois électrons non appariés dans la dernière coquille. Dans ce cas, la valence de l’atome d’arsenic est de 3.
Les états d’oxydation de l’arsenic dépendent de la formation de la liaison. L’état d’oxydation de l’arsenic est de +3. L’état d’oxydation de l’arsenic +3 a été utilisé dans l’arséniure de gallium (GaAs). La valence de l’arsenic dans ce composé est de 3.