El elemento 33 de la tabla periódica es el arsénico. El elemento del grupo-15 es arsénico y su símbolo es «Como». El arsénico forma enlaces a través de sus electrones de valencia. Este artículo analiza en detalle los electrones de valencia del arsénico. Con suerte, después de leer este artículo, conocerá en detalle los electrones de valencia del arsénico(Como).
Tabla de Contenidos
- ¿Cuántos electrones y protones tiene el arsénico?
- ¿Cuáles son los electrones de valencia del arsénico (As)?
- ¿Cómo se calcula el número de electrones de valencia en un átomo de arsénico?
- Paso-1: Determinar el número total de electrones en arsénico(As)
- Paso 2: Necesidad de hacer la configuración electrónica de arsénico
- Paso 3: Determinar la capa de valencia y calcular el total de electrones
- ¿Cuántos electrones de valencia tiene el ion arsénico(As3 -)?
- ¿Cuál es la valencia del arsénico?
¿Cuántos electrones y protones tiene el arsénico?
El núcleo está situado en el centro del átomo. Los protones y neutrones se encuentran en el núcleo. El número atómico de arsénico (As) es 33. El número atómico es el número de protones.
Es decir, el número de protones en el arsénico es de treinta y tres. Electrones iguales a protones se encuentran en una capa circular fuera del núcleo. Es decir, un átomo de arsénico tiene un total de treinta y tres electrones.
¿Cuáles son los electrones de valencia del arsénico (As)?
El número total de electrones en la última capa después de la configuración electrónica del arsénico se denomina electrones de valencia del arsénico. El electrón de valencia es el número total de electrones en la última órbita(caparazón).

Los electrones de valencia determinan las propiedades del elemento y participan en la formación de enlaces. El elemento 33 de la tabla periódica es el arsénico (As). Es decir, el átomo del elemento arsénico tiene un total de treinta y tres electrones.
La configuración electrónica del arsénico muestra que la última capa de arsénico tiene un total de cinco electrones. Es decir, podemos decir fácilmente que los electrones de valencia del arsénico son cinco. Hay un artículo en este sitio que detalla la configuración electrónica del arsénico, puede leerlo si lo desea.
¿Cómo se calcula el número de electrones de valencia en un átomo de arsénico?
Ahora sabremos cómo determinar fácilmente los electrones de valencia del arsénico. El electrón de valencia debe determinarse siguiendo unos pocos pasos. La configuración electrónica es una de ellas. No es posible determinar el electrón de valencia sin configuración electrónica.
Conociendo la configuración electrónica de la manera correcta, es muy fácil determinar los electrones de valencia de todos los elementos. Hay un artículo publicado en este sitio que detalla la configuración electrónica, puede leerlo si lo desea. Sin embargo, este artículo discute brevemente la configuración electrónica.
El científico Niels Bohr fue el primero en dar una idea de la órbita del átomo. Proporcionó un modelo del átomo en 1913. La idea completa de la órbita se da allí. Los electrones del átomo giran alrededor del núcleo en una trayectoria circular determinada. Estas trayectorias circulares se llaman órbita (caparazón). Estas órbitas se expresan por n.
K es el nombre de la primera órbita(concha), L es la segunda, M es la tercera, N es el nombre de la cuarta concha. La capacidad de retención de electrones de cada órbita es de 2n2.
Ahora,
- n = 1 para K órbita.
La capacidad de retención de electrones de la órbita K es 2n2 = 2 × 12 = 2 electrones. - Para órbita L, n = 2.
La capacidad de retención de electrones de la órbita L es 2n2 = 2 × 22 = 8 electrones. - n=3 para órbita M.
La capacidad máxima de retención de electrones en órbita M es 2n2 = 2 × 32 = 18 electrones. - n = 4 para órbita N.
La capacidad máxima de retención de electrones en órbita N es 2n2 = 2 × 42 = 32 electrones.
Además de este método, la configuración electrónica se puede hacer a través de sub-órbitas. El físico alemán Aufbau propuso por primera vez una idea de configuración electrónica a través de sub-órbitas. El método Aufbau consiste en realizar la configuración electrónica a través del nivel de subenergía.
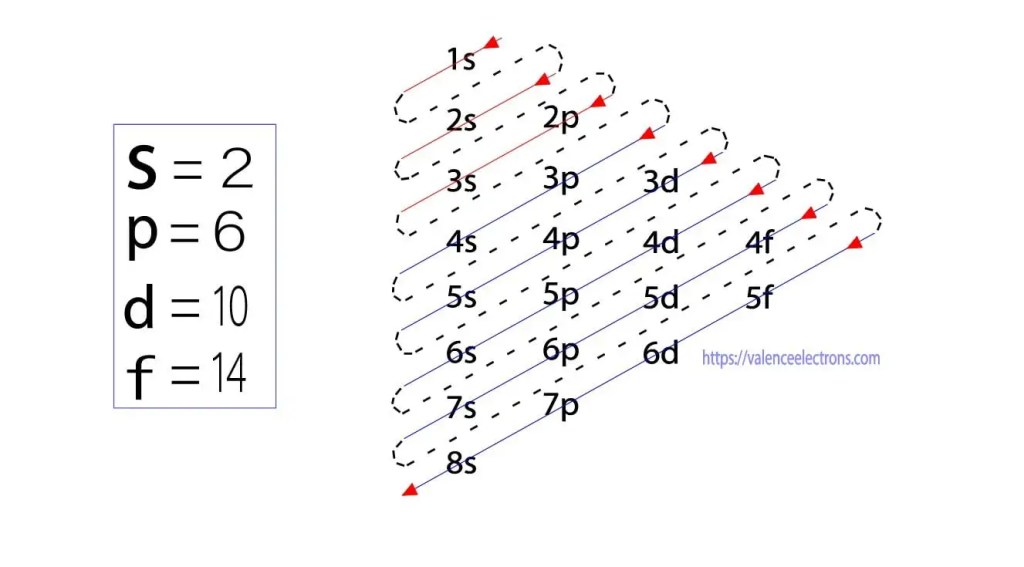
Estos sub-orbitales se expresan por ‘l’. El principio de Aufbau es que los electrones presentes en el átomo completarán primero el orbital de energía más baja y luego continuarán completando gradualmente el orbital de energía más alta. Estos orbitales se denominan s, p, d, f. La capacidad de retención de electrones de estos orbitales es s = 2, p = 6, d = 10 y f = 14.
Sin embargo, los electrones de valencia se pueden identificar fácilmente disponiendo electrones de acuerdo con el principio de Bohr. Ahora aprenderemos a determinar el electrón de valencia del arsénico (As).
Paso-1: Determinar el número total de electrones en arsénico(As)
1er necesitamos conocer el número total de electrones en el átomo de arsénico. Para saber el número de electrones, es necesario saber el número de protones en el arsénico. Y para saber el número de protones, necesitas saber el número atómico del elemento arsénico.
Para saber el número atómico necesitamos tomar la ayuda de una tabla periódica. Es necesario conocer el número atómico de los elementos de arsénico(As) de la tabla periódica. El número atómico es el número de protones. Y electrones iguales a protones se encuentran fuera del núcleo.

Es decir, finalmente podemos decir que hay electrones iguales al número atómico en el átomo de arsénico. De la tabla periódica, vemos que el número atómico de arsénico(As) es 33. Es decir, el átomo de arsénico tiene un total de treinta y tres electrones.
Paso 2: Necesidad de hacer la configuración electrónica de arsénico
El paso 2 es muy importante. En este paso, los electrones del arsénico tienen que estar dispuestos. Sabemos que los átomos de arsénico(As) tienen un total de treinta y tres electrones. La configuración electrónica del arsénico muestra que hay dos electrones en la capa K, ocho en la capa L, dieciocho en la capa M y cinco en la capa N(órbita).

Es decir, la primera capa de arsénico tiene dos electrones, la segunda capa tiene ocho electrones, la tercera capa tiene dieciocho electrones y la cuarta capa(última órbita) tiene cinco electrones. El número de electrones por capa de arsénico (As) es de 2, 8, 18, 5. La configuración electrónica del arsénico a través de la sub-órbita es 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3.
Paso 3: Determinar la capa de valencia y calcular el total de electrones
El tercer paso es diagnosticar la capa de valencia. La última capa después de la configuración electrónica se llama capa de valencia (órbita). El número total de electrones en una capa de valencia se denomina electrón de valencia. La configuración electrónica del arsénico(As) muestra que la última capa de arsénico tiene cinco electrones. Por lo tanto, los átomos de arsénico tienen 5 electrones de valencia.
¿Cuántos electrones de valencia tiene el ion arsénico(As3 -)?
Los elementos que tienen 5, 6 o siete electrones en la última capa(órbita) reciben los electrones en la última capa durante la formación de enlaces. Los elementos que reciben electrones y forman enlaces se llaman aniones. Es decir, el arsénico (As) es un elemento anión.
As + 3e – → As3 –
Durante la formación de enlaces de arsénico, la última capa recibe electrones y los convierte en iones de arsénico(As3-). La configuración electrónica de los iones de arsénico (As3-) es 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6.
La configuración electrónica de los iones de arsénico muestra que los iones de arsénico(As3-) tienen cuatro capas y la última capa tiene ocho electrones (4s2 4p6). La configuración electrónica muestra que el átomo de arsénico ha adquirido la configuración electrónica del criptón. Dado que la última capa de un ion arsénico tiene ocho electrones, los electrones de valencia de los iones arsénico(As3-) son ocho.
¿Cuál es la valencia del arsénico?
La capacidad de un átomo de un elemento para unirse a otro átomo durante la formación de una molécula se llama valencia (valencia). El número de electrones no apareados en la última órbita de un elemento es la valencia de ese elemento. En la configuración electrónica del arsénico (As), vemos que existen cinco electrones en la última capa del arsénico. Por lo tanto, la valencia del arsénico(As) es 5.

De nuevo, la valencia se determina a partir de la configuración electrónica del elemento en el estado excitado. La configuración electrónica del arsénico en estado excitado es As*(33) = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4px1 4py1 4pz1. Aquí, la configuración electrónica del arsénico muestra que tres electrones no apareados existen en la última capa. En este caso, la valencia del átomo de arsénico es 3.
Los estados de oxidación del arsénico dependen de la formación de enlaces. El estado de oxidación del arsénico es +3. El estado de oxidación del arsénico + 3 se ha utilizado en el arseniuro de galio (GaAs). La valencia del arsénico en este compuesto es 3.