Il 33 ° elemento della tavola periodica è l’arsenico. L’elemento del gruppo-15 è arsenico e il suo simbolo è ‘As’. L’arsenico forma legami attraverso i suoi elettroni di valenza. Questo articolo discute in dettaglio gli elettroni di valenza dell’arsenico. Speriamo che, dopo aver letto questo articolo si sa in dettaglio circa l’arsenico(As) elettroni di valenza.
Indice
- Quanti elettroni e protoni ha l’arsenico?
- Quali sono gli elettroni di valenza dell’arsenico(As)?
- Come si calcola il numero di elettroni di valenza in un atomo di arsenico?
- Step-1: Determinazione del numero totale di elettroni nell’arsenico(As)
- Passo-2: Bisogno di fare configurazione elettronica di arsenico
- Passo-3: Determinare il guscio di valenza e calcolare gli elettroni totali
- Quanti elettroni di valenza ha lo arsen arsenico (As3 -)?
- Qual è la valenza dell’arsenico?
Quanti elettroni e protoni ha l’arsenico?
Il nucleo si trova al centro dell’atomo. Protoni e neutroni si trovano nel nucleo. Il numero atomico di arsenico (As) è 33. Il numero atomico è il numero di protoni.
Cioè, il numero di protoni nell’arsenico è trentatré. Gli elettroni uguali ai protoni si trovano in un guscio circolare all’esterno del nucleo. Cioè, un atomo di arsenico ha un totale di trentatré elettroni.
Quali sono gli elettroni di valenza dell’arsenico(As)?
Il numero totale di elettroni nell’ultimo guscio dopo la configurazione elettronica dell’arsenico è chiamato elettroni di valenza dell’arsenico. L’elettrone di valenza è il numero totale di elettroni nell’ultima orbita (shell).

Gli elettroni di valenza determinano le proprietà dell’elemento e partecipano alla formazione di legami. Il 33 ° elemento nella tavola periodica è l’arsenico (As). Cioè, l’atomo dell’elemento arsenico ha un totale di trentatré elettroni.
La configurazione elettronica dell’arsenico mostra che l’ultimo guscio di arsenico ha un totale di cinque elettroni. Cioè, possiamo facilmente dire che gli elettroni di valenza dell’arsenico sono cinque. C’è un articolo su questo sito che descrive in dettaglio la configurazione elettronica dell’arsenico, puoi leggerlo se vuoi.
Come si calcola il numero di elettroni di valenza in un atomo di arsenico?
Ora sapremo come determinare facilmente gli elettroni di valenza dell’arsenico. L’elettrone di valenza deve essere determinato seguendo alcuni passaggi. La configurazione elettronica è una di queste. Non è possibile determinare l’elettrone di valenza senza configurazione elettronica.
Conoscendo la configurazione elettronica nel modo giusto, è molto facile determinare gli elettroni di valenza di tutti gli elementi. C’è un articolo pubblicato su questo sito che descrive in dettaglio la configurazione elettronica, puoi leggerlo se vuoi. Tuttavia, questo articolo discute brevemente la configurazione elettronica.
Lo scienziato Niels Bohr fu il primo a dare un’idea dell’orbita dell’atomo(shell). Ha fornito un modello dell’atomo nel 1913. L’idea completa dell’orbita è data lì. Gli elettroni dell’atomo ruotano attorno al nucleo in un certo percorso circolare. Questi percorsi circolari sono chiamati orbita (shell). Queste orbite sono espresse da n.
K è il nome della prima orbita(shell), L è la seconda, M è la terza, N è il nome della quarta shell. La capacità di tenuta dell’elettrone di ogni orbita è 2n2.
Ora,
- n = 1 per K orbita.
La capacità di tenuta degli elettroni dell’orbita K è 2n2 = 2 × 12 = 2 elettroni. - Per L orbita, n = 2.
La capacità di tenuta degli elettroni dell’orbita L è 2n2 = 2 × 22 = 8 elettroni. - n=3 per M orbita.
La capacità massima di tenuta degli elettroni in orbita M è 2n2 = 2 × 32 = 18 elettroni. - n=4 per N orbita.
La capacità massima di tenuta degli elettroni in orbita N è 2n2 = 2 × 42 = 32 elettroni.
Oltre a questo metodo, la configurazione elettronica può essere eseguita attraverso sub-orbite. Il fisico tedesco Aufbau propose per la prima volta un’idea di configurazione elettronica attraverso sub-orbite. Il metodo Aufbau è quello di fare la configurazione elettronica attraverso il livello di sotto-energia.
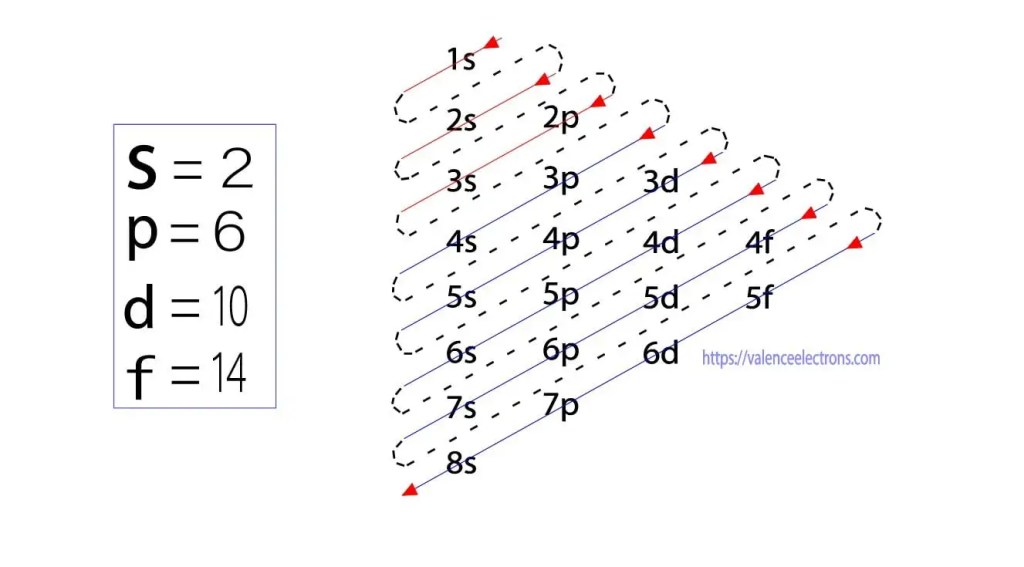
Questi sub-orbitali sono espressi da “l”. Il principio di Aufbau è che gli elettroni presenti nell’atomo completeranno prima l’orbitale di energia più bassa e poi gradualmente continueranno a completare l’orbitale di energia più alta. Questi orbitali sono denominati s, p, d, f. La capacità di tenuta degli elettroni di questi orbitali è s = 2, p = 6, d = 10 e f = 14.
Tuttavia, gli elettroni di valenza possono essere facilmente identificati disponendo gli elettroni secondo il principio di Bohr. Ora impareremo come determinare l’elettrone di valenza dell’arsenico (As).
Step-1: Determinazione del numero totale di elettroni nell’arsenico(As)
1st dobbiamo conoscere il numero totale di elettroni nell’atomo di arsenico. Per conoscere il numero di elettroni, è necessario conoscere il numero di protoni nell’arsenico. E per conoscere il numero di protoni, è necessario conoscere il numero atomico dell’elemento arsenico.
Per conoscere il numero atomico dobbiamo prendere l’aiuto di una tavola periodica. È necessario conoscere il numero atomico degli elementi di arsenico(As) dalla tavola periodica. Il numero atomico è il numero di protoni. E gli elettroni uguali ai protoni si trovano all’esterno del nucleo.

Cioè, possiamo finalmente dire che ci sono elettroni uguali al numero atomico nell’atomo di arsenico. Dalla tavola periodica, vediamo che il numero atomico di arsenico(As) è 33. Cioè, l’atomo di arsenico ha un totale di trentatré elettroni.
Passo-2: Bisogno di fare configurazione elettronica di arsenico
Step-2 è molto importante. In questo passaggio, gli elettroni dell’arsenico devono essere disposti. Sappiamo che gli atomi di arsenico(As) hanno un totale di trentatré elettroni. La configurazione elettronica dell’arsenico mostra che ci sono due elettroni nel guscio K, otto nel guscio L, diciotto nel guscio M e cinque nel guscio N(orbita).

Cioè, il primo guscio di arsenico ha due elettroni, il secondo guscio ha otto elettroni, il 3 ° guscio ha diciotto elettroni e il 4 ° guscio(ultima orbita) ha cinque elettroni. Il numero di elettroni per guscio di arsenico (As) è 2, 8, 18, 5. La configurazione elettronica dell’arsenico attraverso la sub-orbita è 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3.
Passo-3: Determinare il guscio di valenza e calcolare gli elettroni totali
Il terzo passo è quello di diagnosticare il guscio di valenza. L’ultima shell dopo la configurazione elettronica è chiamata shell di valenza (orbita). Il numero totale di elettroni in un guscio di valenza è chiamato elettrone di valenza. La configurazione elettronica dell’arsenico (As) mostra che l’ultimo guscio di arsenico ha cinque elettroni. Pertanto, gli atomi di arsenico hanno 5 elettroni di valenza.
Quanti elettroni di valenza ha lo arsen arsenico (As3 -)?
Gli elementi che hanno 5, 6 o sette elettroni nell’ultimo guscio(orbita) ricevono gli elettroni nell’ultimo guscio durante la formazione del legame. Gli elementi che ricevono elettroni e formano legami sono chiamati anioni. Cioè, l’arsenico (As) è un elemento anionico.
As + 3e– → As3-
Durante la formazione dei legami arsenico, l’ultimo guscio riceve elettroni e li trasforma in ioni arsenico(As3-). La configurazione elettronica degli ioni arsenico(As3-) è 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6.
La configurazione elettronica degli ioni arsenico mostra che gli ioni arsenico(As3-) hanno quattro gusci e l’ultimo guscio ha otto elettroni(4s2 4p6). La configurazione elettronica mostra che l’atomo di arsenico ha acquisito la configurazione elettronica di krypton. Poiché l’ultimo guscio di uno arsen arsenico ha otto elettroni, gli elettroni di valenza degli ioni arsenico(As3-) sono otto.
Qual è la valenza dell’arsenico?
La capacità di un atomo di un elemento di unirsi a un altro atomo durante la formazione di una molecola è chiamata valenza (valenza). Il numero di elettroni spaiati nell’ultima orbita di un elemento è la valenza di quell’elemento. Nella configurazione elettronica per arsenico(As), vediamo che cinque elettroni esistono nell’ultimo guscio dell’arsenico. Pertanto, la valenza dell’arsenico (As) è 5.

Ancora una volta, la valenza è determinata dalla configurazione elettronica dell’elemento nello stato eccitato. La configurazione elettronica dell’arsenico nello stato eccitato è come*(33) = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4px1 4py1 4pz1. Qui, la configurazione elettronica dell’arsenico mostra che tre elettroni spaiati esistono nell’ultimo guscio. In questo caso, la valenza dell’atomo di arsenico è 3.
Gli stati di ossidazione dell’arsenico dipendono dalla formazione del legame. Lo stato di ossidazione dell’arsenico è + 3. Lo stato di ossidazione dell’arsenico + 3 è stato utilizzato nell’arseniuro di gallio (GaAs). La valenza dell’arsenico in questo composto è 3.