det 33: e elementet i det periodiska systemet är arsenik. Elementet i Grupp – 15 är arsenik och dess symbol är ’As’. Arsenik bildar bindningar genom sina valenselektroner. Denna artikel diskuterar i detalj arsenens valenselektroner. Förhoppningsvis, efter att ha läst den här artikeln kommer du att veta i detalj om arsenik(As) valenselektroner.
Innehållsförteckning
- hur många elektroner och protoner har arsenik?
- Vad är valenselektronerna av arsenik (As)?
- Hur beräknar du antalet valenselektroner i en arsenatom?
- Steg-1: Bestämning av det totala antalet elektroner i arsenik(As)
- steg-2: Behöver göra elektronkonfiguration av arsenik
- steg-3: Bestäm valensskalet och beräkna totala elektroner
- hur många valenselektroner har arsenikjon (As3 -)?
- vad är arsenikens Valens?
hur många elektroner och protoner har arsenik?
kärnan ligger i mitten av atomen. Protoner och neutroner finns i kärnan. Atomantalet arsenik(As) är 33. Atomnumret är antalet protoner.
det vill säga antalet protoner i arsenik är trettiotre. Elektroner lika med protoner ligger i ett cirkulärt skal utanför kärnan. Det vill säga en arsenatom har totalt trettiotre elektroner.
Vad är valenselektronerna av arsenik (As)?
det totala antalet elektroner i det sista skalet efter elektronkonfigurationen av arsenik kallas arsenens valenselektroner. Valenselektronen är det totala antalet elektroner i den sista banan(skalet).

valenselektronerna bestämmer elementets egenskaper och deltar i bildandet av bindningar. Det 33: e elementet i det periodiska systemet är arsenik(As). Det vill säga atomen i arsenelementet har totalt trettiotre elektroner.
elektronkonfigurationen av arsenik visar att det sista skalet av arsenik har totalt fem elektroner. Det kan vi lätt säga att arsenens valenselektroner är fem. Det finns en artikel på denna sida som beskriver elektronkonfigurationen av arsenik, du kan läsa den om du vill.
Hur beräknar du antalet valenselektroner i en arsenatom?
nu kommer vi att veta hur man enkelt bestämmer arsenens valenselektroner. Valenselektronen måste bestämmas genom att följa några steg. Elektronkonfigurationen är en av dem. Det är inte möjligt att bestämma valenselektronen utan elektronkonfiguration.
att veta elektronkonfigurationen på rätt sätt är det väldigt enkelt att bestämma valenselektronerna för alla element. Det finns en artikel publicerad på denna sida som beskriver elektronkonfigurationen, du kan läsa den om du vill. Denna artikel diskuterar dock kortfattat elektronkonfiguration.
forskaren Niels Bohr var den första som gav en uppfattning om atomens bana(skal). Han tillhandahöll en modell av atomen 1913. Den fullständiga tanken på banan ges där. Atomens elektroner roterar runt kärnan i en viss cirkulär bana. Dessa cirkulära vägar kallas bana (skal). Dessa banor uttrycks av n.
K är namnet på den första banan(skal), L är den andra, M är den tredje, N är namnet på det fjärde skalet. Elektronhållningskapaciteten för varje bana är 2N2.
nu,
- n = 1 för K bana.
elektronhållningskapaciteten för K-bana är 2N2 = 2 kcal 12 = 2 elektroner. - för L bana, n = 2.
elektronhållningskapaciteten för L-banan är 2N2 = 2 22 xnumx xnumx xnumx xnumx elektroner. - n=3 för M bana.
den maximala elektronhållningskapaciteten I m-bana är 2N2 = 2 kcal 32 = 18 elektroner. - n=4 för N bana.
den maximala elektronhållningskapaciteten i n-bana är 2N2 = 2 kcal 42 = 32 elektroner.
förutom denna metod kan elektronkonfiguration göras genom delbanor. Den tyska fysikern Aufbau föreslog först en uppfattning om elektronkonfiguration genom subbanor. Aufbau-metoden är att göra elektronkonfiguration genom subenerginivån.
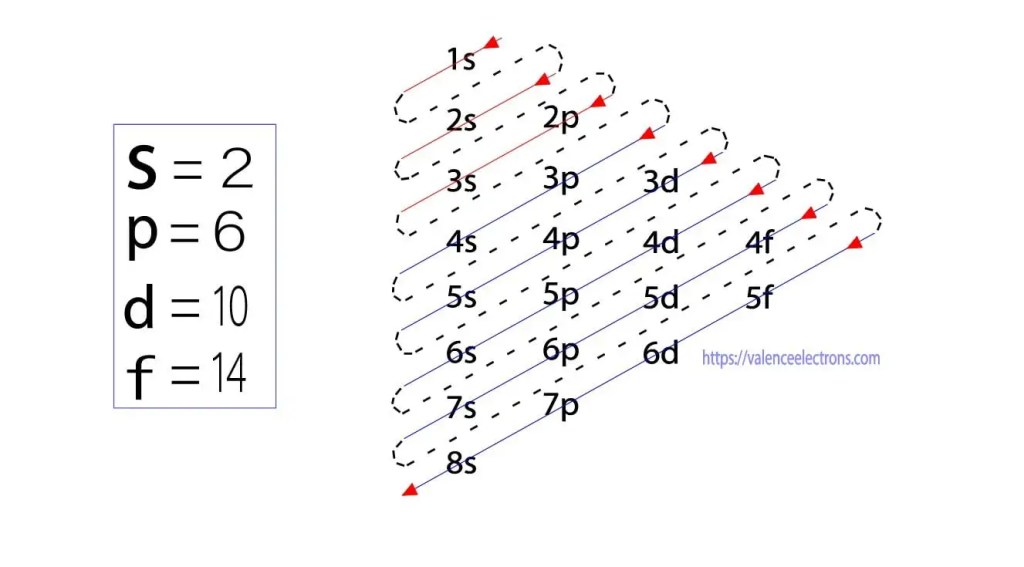
dessa suborbitaler uttrycks av ’l’. Aufbau-principen är att de elektroner som finns i atomen först kommer att slutföra den lägsta energibanan och sedan gradvis fortsätta att slutföra den högre energibanan. Dessa orbitaler heter s, p, d, f. elektronhållningskapaciteten hos dessa orbitaler är s = 2, p = 6, d = 10 och f = 14.
valenselektroner kan emellertid lätt identifieras genom att ordna elektroner enligt Bohr-principen. Nu kommer vi att lära oss hur man bestämmer arsenens valenselektron(As).
Steg-1: Bestämning av det totala antalet elektroner i arsenik(As)
1: A Vi behöver veta det totala antalet elektroner i arsenikatomen. För att veta antalet elektroner måste du veta antalet protoner i arsenik. Och för att veta antalet protoner måste du veta atomnumret för arsenelementet.
för att känna till atomnumret måste vi ta hjälp av ett periodiskt bord. Det är nödvändigt att känna till atomantalet arsenik(As) – element från det periodiska bordet. Atomnumret är antalet protoner. Och elektroner lika med protoner ligger utanför kärnan.

det vill säga, vi kan äntligen säga att det finns elektroner lika med atomnumret i arsenikatomen. Från det periodiska systemet ser vi att atomantalet arsenik(As) är 33. Det vill säga arsenatomen har totalt trettiotre elektroner.
steg-2: Behöver göra elektronkonfiguration av arsenik
steg-2 är mycket viktigt. I detta steg måste elektronerna av arsenik ordnas. Vi vet att arsenik (As) atomer har totalt trettiotre elektroner. Elektronkonfigurationen för arsenik visar att det finns två elektroner i K-skalet, åtta i L-skalet, arton I m-skalet och fem i N-skalet(bana).

det vill säga det första skalet av arsenik har två elektroner, det andra skalet har åtta elektroner, det 3: e skalet har arton elektroner och det 4: e skalet(sista banan) har fem elektroner. Antalet elektroner per skal av arsenik (As) är 2, 8, 18, 5. Elektronkonfigurationen av arsenik genom subbanan är 1S2 2S2 2P6 3s2 3P6 4s2 3d10 4p3.
steg-3: Bestäm valensskalet och beräkna totala elektroner
det tredje steget är att diagnostisera valensskalet. Det sista skalet efter elektronkonfigurationen kallas valensskalet (bana). Det totala antalet elektroner i ett valensskal kallas en valenselektron. Elektronkonfigurationen av arsenik (As) visar att det sista skalet av arsenik har fem elektroner. Därför har arsenatomer 5 valenselektroner.
hur många valenselektroner har arsenikjon (As3 -)?
de element som har 5, 6 eller sju elektroner i det sista skalet(bana) tar emot elektronerna i det sista skalet under bindningsbildning. De element som tar emot elektroner och bildar bindningar kallas anjoner. Det vill säga arsenik(As) är ett anjonelement.
As + 3e– ACC AS3-
under bildandet av arsenbindningar mottar det sista skalet elektroner och förvandlar dem till arsenjoner(As3-). Elektronkonfigurationen av arsenjoner (As3 -) är 1S2 2S2 2P6 3s2 3P6 4s2 3d10 4p6.
elektronkonfigurationen av arsenjoner visar att arsenjoner(As3-) har fyra skal och det sista skalet har åtta elektroner(4s2 4p6). Elektronkonfigurationen visar att arsenatomen har förvärvat elektronkonfigurationen av krypton. Eftersom det sista skalet av en arsenjon har åtta elektroner, är valenselektronerna av arsenjoner (As3-) åtta.
vad är arsenikens Valens?
förmågan hos en atom av ett element att ansluta sig till en annan atom under bildandet av en molekyl kallas Valens (Valens). Antalet oparade elektroner i det sista omloppet av ett element är valensen för det elementet. I elektronkonfigurationen för arsenik(As) ser vi att fem elektroner finns i arsenets sista skal. Därför är arsenikens Valens (As) 5.

återigen bestäms Valens från elementets elektronkonfiguration i det upphetsade tillståndet. Elektronkonfigurationen av arsenik i exciterat tillstånd är som * (33) = 1S2 2S2 2P6 3s2 3P6 4s2 3d10 4px1 4py1 4pz1. Här visar elektronkonfigurationen av arsenik att tre oparade elektroner finns i det sista skalet. I detta fall är arsenatomens Valens 3.
oxidationstillstånden för arsenik beror på bindningsbildningen. Oxidationstillståndet för arsenik är + 3. Oxidationstillståndet för arsenik + 3 har använts i galliumarsenid (GaAs). Arsenikens Valens i denna förening är 3.