al 33-lea element al tabelului periodic este arsenicul. Elementul grupului-15 este arsenicul și simbolul său este ‘As’. Arsenicul formează legături prin electronii săi de valență. Acest articol discută în detaliu electronii de valență ai arsenicului. Sperăm că, după ce ați citit acest articol, veți ști în detaliu despre electronii de valență arsenic (As).
cuprins
- câți electroni și protoni are arsenicul?
- care sunt electronii de valență ai arsenicului(As)?
- Cum calculați numărul de electroni de valență într-un atom de arsen?
- Pasul 1: Determinarea numărului total de electroni din arsenic(As)
- Pasul 2: Necesitatea de a face configurația electronică a arsenicului
- Pasul 3: Determinați învelișul de valență și calculați electronii totali
- câți electroni de valență are ionul arsenic(As3 -)?
- care este valența arsenicului?
câți electroni și protoni are arsenicul?
nucleul este situat în centrul atomului. Protonii și neutronii sunt localizați în nucleu. Numărul atomic de arsenic (As) este 33. Numărul atomic este numărul de protoni.
adică numărul de protoni din arsenic este de treizeci și trei. Electronii egali cu protonii sunt localizați într-o coajă circulară în afara nucleului. Adică, un atom de arsen are un total de treizeci și trei de electroni.
care sunt electronii de valență ai arsenicului(As)?
numărul total de electroni din ultima coajă după configurația electronică a arsenicului se numește electroni de valență ai arsenicului. Electronul de valență este numărul total de electroni din ultima orbită(coajă).

electronii de valență determină proprietățile elementului și participă la formarea legăturilor. Al 33-lea element din tabelul periodic este arsenicul(As). Adică, atomul elementului arsenic are un total de treizeci și trei de electroni.
configurația electronică a arsenicului arată că ultima coajă de arsenic are un total de cinci electroni. Adică, putem spune cu ușurință că electronii de valență ai arsenicului sunt cinci. Există un articol pe acest site care detaliază configurația electronică a arsenicului, îl puteți citi dacă doriți.
Cum calculați numărul de electroni de valență într-un atom de arsen?
acum vom ști cum să determinăm cu ușurință electronii de valență ai arsenicului. Electronul de valență trebuie determinat urmând câțiva pași. Configurația electronică este una dintre ele. Nu este posibil să se determine electronul de valență fără configurația electronică.
cunoscând configurația electronică în mod corect, este foarte ușor să determinăm electronii de valență ai tuturor elementelor. Există un articol publicat pe acest site care detaliază configurația electronică, îl puteți citi dacă doriți. Cu toate acestea, acest articol discută pe scurt configurația electronică.
omul de știință Niels Bohr a fost primul care a dat o idee despre orbita atomului(shell). El a furnizat un model al atomului în 1913. Ideea completă a orbitei este dată acolo. Electronii atomului se învârt în jurul nucleului într-o anumită cale circulară. Aceste căi circulare se numesc orbită (coajă). Aceste orbite sunt exprimate prin n.
K este numele primei orbite(coajă), L este al doilea, M este al treilea, N este numele celei de-a patra cochilii. Capacitatea de reținere a electronilor fiecărei orbite este 2n2.
acum,
- n = 1 Pentru k orbită.
capacitatea de reținere a electronilor de pe orbita K este de 2N2 = 2 x12 = 2 electroni. - pentru orbita L, n = 2.
capacitatea de reținere a electronilor pe orbita L este de 2N2 = 2 22 = 8 electroni. - n = 3 pentru orbita M.
capacitatea maximă de reținere a electronilor pe orbita M este de 2N2 = 2 32 = 18 electroni. - n = 4 Pentru n orbită.
capacitatea maximă de reținere a electronilor pe orbita N este de 2N2 = 2 x,42 = 32 electroni.
în plus față de această metodă, configurația electronică se poate face prin sub-orbite. Fizicianul German Aufbau a propus mai întâi o idee de configurare electronică prin sub-orbite. Metoda Aufbau este de a face configurația electronică prin nivelul de sub-energie.
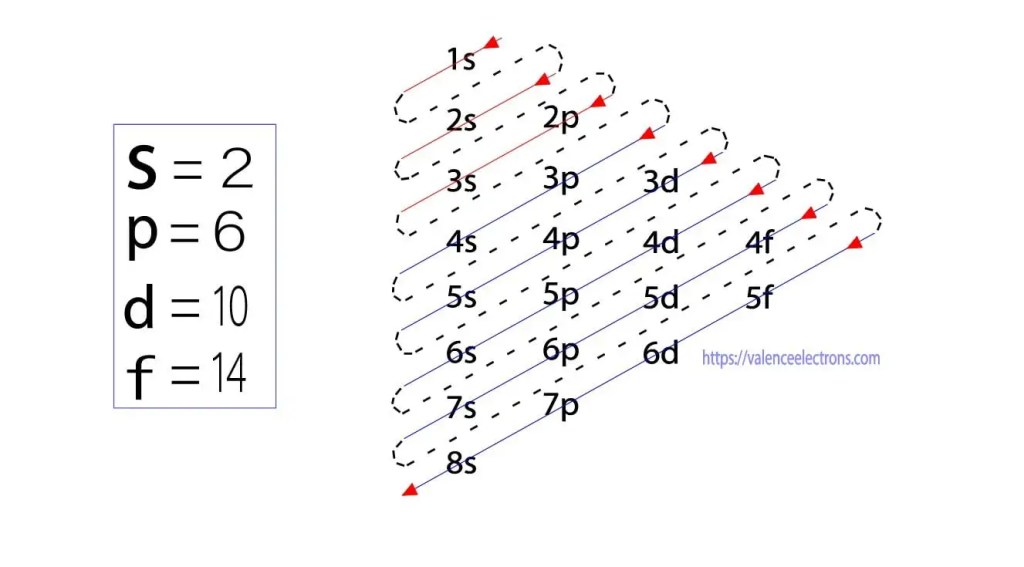
acești sub-orbitali sunt exprimați prin’l’. Principiul Aufbau este că electronii prezenți în atom vor finaliza mai întâi orbitalul cu cea mai mică energie și apoi vor continua treptat să completeze orbitalul cu energie superioară. Acești orbitali sunt numiți s, p, d, f. capacitatea de reținere a electronilor acestor orbitali este s = 2, p = 6, d = 10 și f = 14.
cu toate acestea, electronii de valență pot fi ușor identificați prin aranjarea electronilor conform principiului Bohr. Acum vom învăța cum să determinăm electronul de valență al arsenicului(As).
Pasul 1: Determinarea numărului total de electroni din arsenic(As)
1 trebuie să cunoaștem numărul total de electroni din atomul de arsen. Pentru a cunoaște numărul de electroni, trebuie să cunoașteți numărul de protoni din arsenic. Și pentru a cunoaște numărul de protoni, trebuie să cunoașteți numărul atomic al elementului arsenic.
pentru a cunoaște numărul atomic avem nevoie de ajutorul unui tabel periodic. Este necesar să se cunoască numărul atomic de elemente arsenic(As) din tabelul periodic. Numărul atomic este numărul de protoni. Și electronii egali cu protonii sunt localizați în afara nucleului.

adică, putem spune în sfârșit că există electroni egali cu numărul atomic din atomul de arsen. Din tabelul periodic, vedem că numărul atomic de arsenic (As) este 33. Adică atomul de arsen are un total de treizeci și trei de electroni.
Pasul 2: Necesitatea de a face configurația electronică a arsenicului
Pasul-2 este foarte important. În această etapă, electronii arsenicului trebuie aranjați. Știm că atomii de arsen (As) au un total de treizeci și trei de electroni. Configurația electronică a arsenicului arată că există doi electroni în carcasa K, opt în carcasa L, optsprezece în carcasa M și cinci în carcasa N(orbită).

adică, prima coajă de arsen are doi electroni, a doua coajă are opt electroni, a 3-a coajă are optsprezece electroni, iar a 4-a coajă(ultima orbită) are cinci electroni. Numărul de electroni pe coajă de arsen (As) este de 2, 8, 18, 5. Configurația electronică a arsenicului prin sub-orbită este 1s2 2s2 2P6 3s2 3P6 4S2 3d10 4P3.
Pasul 3: Determinați învelișul de valență și calculați electronii totali
al treilea pas este diagnosticarea învelișului de valență. Ultima coajă după configurația electronică se numește coajă de valență(orbită). Numărul total de electroni dintr-o coajă de valență se numește electron de valență. Configurația electronică a arsenicului (As) arată că ultima coajă de arsenic are cinci electroni. Prin urmare, atomii de arsen au 5 electroni de valență.
câți electroni de valență are ionul arsenic(As3 -)?
elementele care au 5, 6 sau șapte electroni în ultima coajă(orbită) primesc electronii din ultima coajă în timpul formării legăturii. Elementele care primesc electroni și formează legături se numesc anioni. Adică arsenicul (As) este un element anionic.
As + 3e– as3-
în timpul formării legăturilor de arsen, ultima coajă primește electroni și îi transformă în ioni de arsen(As3-). Configurația electronică a ionilor de arsen (As3 -) este 1s2 2s2 2P6 3s2 3P6 4S2 3d10 4P6.
configurația electronică a ionilor de arsen arată că ionii de arsen(As3-) au patru cochilii, iar ultima coajă are opt electroni(4S2 4p6). Configurația electronică arată că atomul de arsen a dobândit configurația electronică a kriptonului. Deoarece ultima coajă a unui ion de arsen are opt electroni, electronii de valență ai ionilor de arsen(As3-) sunt opt.
care este valența arsenicului?
capacitatea unui atom al unui element de a uni un alt atom în timpul formării unei molecule se numește valență (valență). Numărul de electroni nepereche pe ultima orbită a unui element este valența acelui element. În configurația electronică pentru arsenic (As), vedem că cinci electroni există în ultima coajă a arsenicului. Prin urmare, valența arsenicului(As) este 5.

din nou, valența este determinată din configurația electronică a elementului în starea excitată. Configurația electronică a arsenicului în stare excitată este ca*(33) = 1s2 2s2 2P6 3s2 3P6 4s2 3d10 4px1 4py1 4pz1. Aici, configurația electronică a arsenicului arată că trei electroni nepereche există în ultima coajă. În acest caz, valența atomului de arsen este 3.
stările de oxidare ale arsenicului depind de formarea legăturii. Starea de oxidare a arsenicului este + 3. Starea de oxidare a arsenicului + 3 a fost utilizată în arsenid de galiu (GaAs). Valența arsenicului în acest compus este 3.