33.pierwiastkiem układu okresowego jest arsen. Pierwiastkiem grupy-15 jest arsen, a jego symbolem jest „As”. Arsen tworzy wiązania poprzez elektrony walencyjne. W tym artykule omówiono szczegółowo elektrony walencyjne arsenu. Mam nadzieję, że po przeczytaniu tego artykułu dowiesz się szczegółowo o arszeniku (jako) elektrony walencyjne.
spis treści
- ile elektronów i protonów ma arszenik?
- jakie są elektrony walencyjne arsenu (As)?
- Jak obliczyć liczbę elektronów walencyjnych w atomie arsenu?
- Krok 1: określenie całkowitej liczby elektronów w atomie arsenu (As)
- Krok-2: Potrzeba zrobienia konfiguracji elektronowej arsenu
- Krok-3: Określ powłokę walencyjną i Oblicz całkowite elektrony
- ile elektronów walencyjnych ma jon arsenu(As3 -)?
- jaka jest wartość arsenu?
ile elektronów i protonów ma arszenik?
jądro znajduje się w centrum atomu. Protony i neutrony znajdują się w jądrze. Liczba atomowa arsenu (As) wynosi 33. Liczba atomowa jest liczbą protonów.
czyli liczba protonów w arszeniku wynosi trzydzieści trzy. Elektrony równe protonom znajdują się w kolistej powłoce poza jądrem. Oznacza to, że atom arsenu ma łącznie trzydzieści trzy elektrony.
jakie są elektrony walencyjne arsenu (As)?
całkowita liczba elektronów w ostatniej powłoce po konfiguracji elektronowej arsenu nazywana jest elektronami walencyjnymi arsenu. Elektron walencyjny to całkowita liczba elektronów na ostatniej orbicie (powłoce).

elektrony walencyjne określają właściwości pierwiastka i uczestniczą w tworzeniu wiązań. 33 pierwiastkiem w układzie okresowym jest arsen (As). Oznacza to, że atom pierwiastka arsenu ma łącznie trzydzieści trzy elektrony.
konfiguracja elektronowa arsenu pokazuje, że ostatnia powłoka arsenu ma w sumie pięć elektronów. Oznacza to, że możemy łatwo powiedzieć, że elektrony walencyjne arsenu wynoszą pięć. Na tej stronie jest artykuł opisujący konfigurację elektronową arsenu, możesz go przeczytać, jeśli chcesz.
Jak obliczyć liczbę elektronów walencyjnych w atomie arsenu?
teraz będziemy wiedzieć, jak łatwo określić elektrony walencyjne arsenu. Elektron walencyjny musi być określony, wykonując kilka kroków. Konfiguracja elektronowa jest jedną z nich. Nie jest możliwe określenie elektronu walencyjnego bez konfiguracji elektronowej.
znając konfigurację elektronową we właściwy sposób, bardzo łatwo jest określić elektrony walencyjne wszystkich elementów. Jest artykuł opublikowany na tej stronie szczegółowo konfiguracji elektronowej, można go przeczytać, jeśli chcesz. Jednak w tym artykule krótko omówiono konfigurację elektronową.
Naukowiec Niels Bohr był pierwszym, który dał wyobrażenie o orbicie atomu (powłoki). W 1913 roku dostarczył model atomu. Podano tam pełną ideę orbity. Elektrony atomu krążą wokół jądra w pewnej okrągłej ścieżce. Te okrągłe ścieżki nazywane są orbitami (shell). Orbity te są wyrażone przez N.
K to nazwa pierwszej orbity(powłoki), L to druga, M to trzecia, N to nazwa czwartej powłoki. Zdolność utrzymywania elektronów na każdej orbicie wynosi 2n2.
teraz,
- n = 1 dla orbity K.
zdolność utrzymywania elektronów na orbicie K wynosi 2N2 = 2 × 12 = 2 elektrony. - dla orbity L, n = 2.
zdolność utrzymywania elektronów na orbicie L wynosi 2N2 = 2 × 22 = 8 elektronów. - n = 3 dla orbity M.
maksymalna zdolność utrzymywania elektronów na orbicie M wynosi 2N2 = 2 × 32 = 18 elektronów. - n = 4 dla orbity N.
maksymalna zdolność utrzymywania elektronów na orbicie N wynosi 2N2 = 2 × 42 = 32 elektrony.
oprócz tej metody, konfiguracja elektronowa może być wykonywana poprzez sub-orbity. Niemiecki fizyk Aufbau jako pierwszy zaproponował koncepcję konfiguracji elektronowej poprzez sub-orbity. Metoda Aufbau polega na konfiguracji elektronów poprzez poziom podenergetyczny.
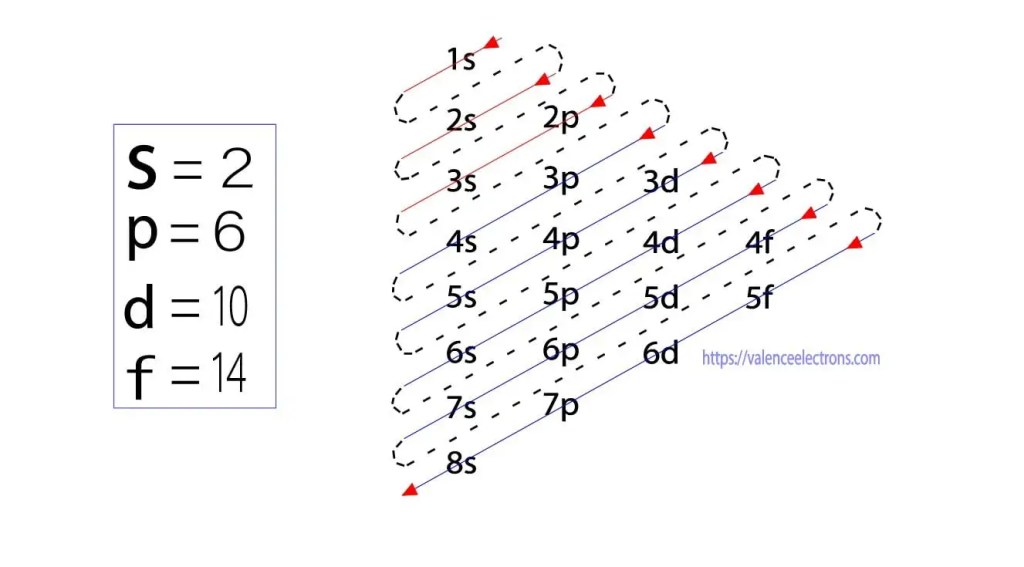
suborbitale te wyrażane są przez „l”. Zasada Aufbau polega na tym, że elektrony obecne w atomie najpierw ukończą Orbital o najniższej energii, a następnie stopniowo kontynuują Ukończenie orbitalu o wyższej energii. Orbitale te nazywane są S, p, d, f. zdolność utrzymywania elektronów przez te orbitale wynosi s = 2, p = 6, d = 10 i f = 14.
jednak elektrony walencyjne mogą być łatwo zidentyfikowane przez ułożenie elektronów zgodnie z zasadą Bohra. Teraz nauczymy się, jak określić elektron walencyjny arsenu (As).
Krok 1: określenie całkowitej liczby elektronów w atomie arsenu (As)
1. musimy znać całkowitą liczbę elektronów w atomie arsenu. Aby poznać liczbę elektronów, trzeba znać liczbę protonów w arszeniku. Aby poznać liczbę protonów, trzeba znać liczbę atomową pierwiastka arsenu.
aby poznać liczbę atomową musimy skorzystać z pomocy układu okresowego. Konieczne jest poznanie liczby atomowej arsen (As) pierwiastków z układu okresowego. Liczba atomowa jest liczbą protonów. Elektrony równe protonom znajdują się poza jądrem.

oznacza to, że w końcu możemy powiedzieć, że elektrony są równe liczbie atomowej w atomie arsenu. Z układu okresowego wynika, że liczba atomowa arsenu(As) wynosi 33. Oznacza to, że atom arsenu ma łącznie trzydzieści trzy elektrony.
Krok-2: Potrzeba zrobienia konfiguracji elektronowej arsenu
Krok 2 jest bardzo ważny. W tym kroku elektrony arsenu muszą być ułożone. Wiemy, że atomy arsenu(As) mają łącznie trzydzieści trzy elektrony. Konfiguracja elektronowa arsenu pokazuje, że w powłoce K są dwa elektrony, osiem w powłoce L, osiemnaście w powłoce M i pięć w powłoce N(Orbita).

oznacza to, że pierwsza powłoka arsenu ma dwa elektrony, druga powłoka ma osiem elektronów, trzecia powłoka ma osiemnaście elektronów, a czwarta powłoka(ostatnia Orbita) ma pięć elektronów. Liczba elektronów na powłokę arsenu (As) wynosi 2, 8, 18, 5. Konfiguracja elektronowa arsenu przez sub-orbitę to 1s2 2s2 2P6 3s2 3p6 4S2 3d10 4P3.
Krok-3: Określ powłokę walencyjną i Oblicz całkowite elektrony
trzecim krokiem jest zdiagnozowanie powłoki walencyjnej. Ostatnia powłoka po konfiguracji elektronowej nazywa się powłoką walencyjną (Orbita). Całkowita liczba elektronów w powłoce walencyjnej nazywa elektron walencyjny. Konfiguracja elektronowa arsenu (As) pokazuje, że ostatnia powłoka arsenu ma pięć elektronów. Dlatego Atomy arsenu mają 5 elektronów walencyjnych.
ile elektronów walencyjnych ma jon arsenu(As3 -)?
pierwiastki, które mają 5, 6 lub 7 elektronów w ostatniej powłoce (orbicie) otrzymują elektrony w ostatniej powłoce podczas tworzenia wiązania. Pierwiastki, które otrzymują elektrony i tworzą wiązania, nazywane są anionami. Oznacza to, że arsen (As) jest pierwiastkiem anionowym.
As + 3e- → As3-
podczas tworzenia wiązań arsenu ostatnia powłoka otrzymuje elektrony i zamienia je w jony arsenu(As3 -). Konfiguracja elektronowa jonów arsenu(As3-) to 1s2 2s2 2P6 3s2 3p6 4S2 3d10 4p6.
konfiguracja elektronowa jonów arsenu pokazuje, że jony arsenu(As3-) mają cztery powłoki, a ostatnia powłoka ma osiem elektronów(4s2 4p6). Konfiguracja elektronowa wskazuje, że atom arsenu uzyskał konfigurację elektronową kryptonu. Ponieważ ostatnia powłoka jonu arsenu ma osiem elektronów, elektrony walencyjne jonów arsenu(As3-) mają osiem.
jaka jest wartość arsenu?
zdolność jednego atomu pierwiastka do przyłączenia się do innego atomu podczas tworzenia cząsteczki nazywa się Walencją (Walencją). Liczba niesparowanych elektronów na ostatniej orbicie pierwiastka jest wartością tego pierwiastka. W konfiguracji elektronowej arsenu (As) widzimy, że w ostatniej powłoce arsenu istnieje pięć elektronów. Dlatego wartość arsenu (As) wynosi 5.

ponownie, Walencja jest określona z konfiguracji elektronowej elementu w stanie wzbudzonym. Konfiguracja elektronowa arsenu w stanie wzbudzonym wynosi: * (33) = 1s2 2S2 2P6 3s2 3p6 4S2 3d10 4px1 4py1 4pz1. Tutaj konfiguracja elektronowa arszenika pokazuje, że w ostatniej powłoce istnieją trzy niesparowane elektrony. W tym przypadku wartość atomu arsenu wynosi 3.
stany utleniania arsenu zależą od tworzenia wiązania. Stan utleniania arsenu wynosi +3. Stan utleniania arsenu +3 został użyty w arsenku galu (GaAs). Wartość arsenu w tym związku wynosi 3.