周期表の33番目の元素はヒ素である。 グループ15の要素はヒ素であり、記号は’As’です。 ヒ素はその価電子を介して結合を形成する。 ヒ素の価電子について詳細に論じた。 うまくいけば、この記事を読んだ後、ヒ素(As)価電子について詳しく知ることができます。
目次
ヒ素は何個の電子と陽子を持っていますか?
核は原子の中心に位置しています。 陽子と中性子は核に位置しています。 ヒ素(As)の原子番号は33である。 原子番号は陽子の数です。
つまり、ヒ素中の陽子の数は三〇から三である。 陽子に等しい電子は、核の外側の円形の殻に位置しています。 すなわち、ヒ素原子は合計33個の電子を有する。
ヒ素(As)の価電子は何ですか?
ヒ素の電子配置後の最後の殻の電子の総数をヒ素の価電子と呼ぶ。 原子価電子は、最後の軌道(シェル)内の電子の総数です。

価電子は元素の特性を決定し、結合の形成に関与する。 周期律表の33番目の元素はヒ素(As)である。 すなわち、ヒ素元素の原子は、合計3 3個の電子を有する。
ヒ素の電子配置は、ヒ素の最後の殻が合計5つの電子を持つことを示しています。 つまり、ヒ素の価電子は5であると簡単に言うことができます。 このサイトにはヒ素の電子配置を詳述した記事がありますが、必要に応じて読むことができます。
ヒ素原子の価電子数はどのように計算しますか?
今、私たちは簡単にヒ素の価電子を決定する方法を知っているでしょう。 原子価電子は、いくつかのステップに従うことによって決定されなければならない。 電子配置もその一つである。 電子配置なしで価電子を決定することはできない。
正しい方法で電子配置を知ることは、すべての要素の価電子を決定することは非常に簡単です。 電子構成を詳述したこのサイトに掲載されている記事があります。 しかし,この記事では電子配置について簡単に論じた。
科学者ニールスボーアは、原子の軌道(シェル)のアイデアを与えた最初の人でした。 彼は1913年に原子のモデルを提供した。 軌道の完全なアイデアがそこに与えられています。 原子の電子は、特定の円形の経路で核の周りを回転します。 これらの円形の経路は軌道(シェル)と呼ばれます。 これらの軌道はnで表されます。
Kは最初の軌道(シェル)の名前、Lは2番目の軌道、Mは3番目の軌道、Nは4番目のシェルの名前です。 各軌道の電子保持能力は2n2である。
,
- K軌道に対してn=1である。
K軌道の電子保持容量は2n2=2×12=2電子である。 - はL軌道の場合、n=2である。
L軌道の電子保持容量は2n2=2×22=8電子である。 - M軌道に対してn=3。
M軌道における最大電子保持容量は、2n2=2×32=18電子である。 - n軌道に対してn=4。
N軌道における最大電子保持容量は、2n2=2×42=32電子である。
この方法に加えて、電子配置はサブ軌道を介して行うことができます。 ドイツの物理学者Aufbauは、最初にサブ軌道を介して電子配置のアイデアを提案しました。 Aufbau法は,サブエネルギー準位を介して電子配置を行うことである。
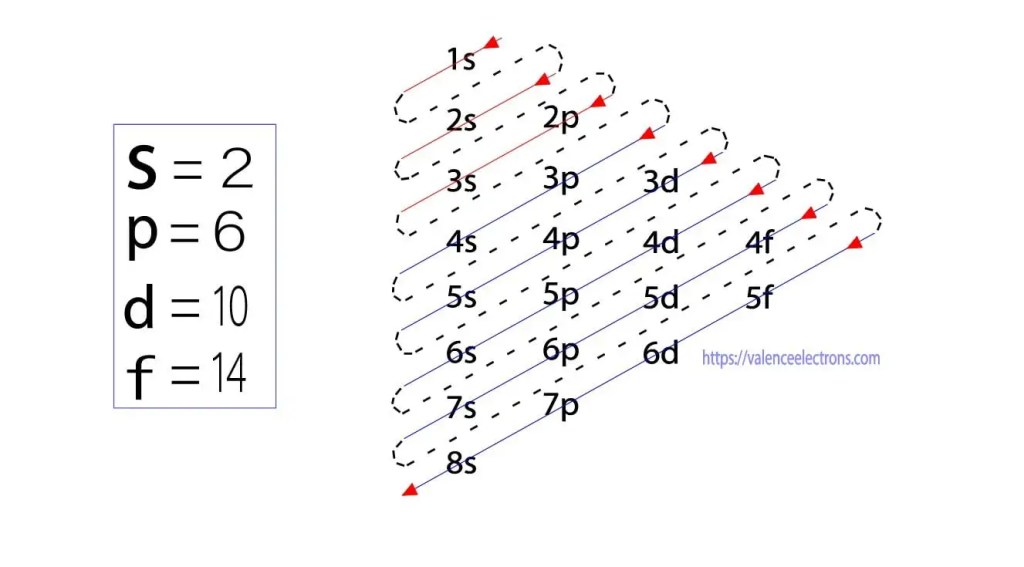
これらのサブ軌道は’l’で表される。 Aufbauの原理は、原子中に存在する電子が最初に最も低いエネルギー軌道を完了し、その後徐々により高いエネルギー軌道を完了し続けることである。 これらの軌道の電子保持容量は、s=2、p=6、d=10、f=14です。
しかし、ボーアの原理に従って電子を配置することによって価電子を容易に同定することができる。 ここで、ヒ素(As)の価電子を決定する方法を学びます。ステップ-1:ヒ素(As)中の電子の総数を決定する
1次に、ヒ素原子中の電子の総数を知る必要があります。 電子の数を知るには、ヒ素中の陽子の数を知る必要があります。 陽子の数を知るには、ヒ素元素の原子番号を知る必要があります。
原子番号を知るためには、周期表の助けを借りなければなりません。 周期表からヒ素(As)元素の原子番号を知る必要があります。 原子番号は陽子の数です。 そして、陽子に等しい電子は核の外側に位置しています。
つまり、ヒ素原子には原子番号に等しい電子があると最終的に言うことができます。 周期表から、ヒ素(As)の原子番号は33であることがわかります。 すなわち、ヒ素原子は、合計3 3個の電子を有する。
ステップ-2: ヒ素の電子配置を行う必要があります
ステップ2は非常に重要です。 このステップでは、ヒ素の電子を配置する必要があります。 ヒ素(As)原子には合計33個の電子があることがわかっています。 ヒ素の電子配置は、K殻に二つの電子があり、L殻に八つ、M殻に八つ、N殻(軌道)に五つの電子があることを示している。

つまり、ヒ素の最初の殻は2つの電子を持ち、2番目の殻は8つの電子を持ち、3番目の殻は18つの電子を持ち、4番目の殻(最後の軌道)は5つの電子を持 ヒ素(As)の殻当たりの電子数は2、8、18、5である。 サブ軌道を通るヒ素の電子配置は1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3である。
ステップ-3: 価電子殻を決定し、全電子を計算する
第三のステップは、価電子殻を診断することです。 電子配置の後の最後の殻は価電子殻(軌道)と呼ばれる。 原子価殻内の電子の総数は、原子価電子と呼ばれます。 ヒ素(A s)の電子配置は,ヒ素の最後の殻が五つの電子を有することを示している。 したがって、ヒ素原子は5価電子を有する。
ヒ素イオン(As3-)はいくつの価電子を持っていますか?
最後の殻(軌道)に5個、6個、または7個の電子を持つ元素は、結合形成中に最後の殻の電子を受け取ります。 電子を受け取り、結合を形成する元素は陰イオンと呼ばれます。 すなわち、ヒ素(A s)は陰イオン元素である。
As+3e–→As3-
ヒ素結合の形成中、最後の殻は電子を受け取り、それらをヒ素イオン(As3-)に変える。 ヒ素イオン(As3-)の電子配置は1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6である。
ヒ素イオンの電子配置は、ヒ素イオン(As3-)が四つの殻を持ち、最後の殻が八つの電子(4s2 4p6)を持つことを示している。 電子配置はヒ素原子がクリプトンの電子配置を獲得したことを示している。 ヒ素イオンの最後の殻は八電子を有するので、ヒ素イオン(As3-)の価電子は八電子である。
ヒ素の原子価は何ですか?
分子の形成中に元素のある原子が別の原子に結合する能力を原子価(valence)と呼びます。 元素の最後の軌道における不対電子の数は、その元素の原子価である。 ヒ素(A s)の電子配置では,ヒ素の最後の殻に五つの電子が存在することが分かった。 したがって、ヒ素(As)の価数は5である。

ここでも、原子価は励起状態の元素の電子配置から決定される。 励起状態におけるヒ素の電子配置は*(33)=1s2 2s2 2p6 3s2 3p6 4s2 3d10 4px1 4py1 4pz1である。 ここで、ヒ素の電子配置は、三つの不対電子が最後の殻に存在することを示している。 この場合、ヒ素原子の原子価は3である。
ヒ素の酸化状態は結合形成に依存する。 ヒ素の酸化状態は+3である。 ヒ素+3の酸化状態は、ヒ化ガリウム(GaAs)に使用されています。 この化合物中のヒ素の原子価は3である。