det 33.element i det periodiske system er arsen. Elementet i gruppe-15 er arsen, og dets symbol er ‘As’. Arsen danner bindinger gennem dets valenselektroner. Denne artikel diskuterer i detaljer valenselektronerne af arsen. Forhåbentlig vil du efter at have læst denne artikel vide detaljeret om arsen(As) valenselektroner.
Indholdsfortegnelse
- hvor mange elektroner og protoner har arsen?
- Hvad er valenselektronerne af arsen (As)?
- Hvordan beregner du antallet af valenselektroner i et arsenatom?
- Trin-1: Bestemmelse af det samlede antal elektroner i arsen(As)
- Trin-2: Behov for at gøre elektronkonfiguration af arsen
- Trin-3: Bestem valensskallen og beregne de samlede elektroner
- hvor mange valenselektroner har arsenion(As3 -)?
- hvad er arsenens Valens?
hvor mange elektroner og protoner har arsen?
kernen er placeret i midten af atomet. Protoner og neutroner er placeret i kernen. Atomnummeret af arsen (As) er 33. Atomnummeret er antallet af protoner.
det vil sige antallet af protoner i arsen er treogtredive. Elektroner svarende til protoner er placeret i en cirkulær skal uden for kernen. Det vil sige, et arsenatom har i alt treogtredive elektroner.
Hvad er valenselektronerne af arsen (As)?
det samlede antal elektroner i den sidste skal efter elektronkonfigurationen af arsen kaldes arsenens valenselektroner. Valenselektronen er det samlede antal elektroner i den sidste bane(skal).

valenselektronerne bestemmer elementets egenskaber og deltager i dannelsen af bindinger. Det 33.element i det periodiske system er arsen(As). Det vil sige, at arsenelementets atom har i alt treogtredive elektroner.
elektronkonfigurationen af arsen viser, at den sidste skal af arsen har i alt fem elektroner. Det vil sige, Vi kan nemt sige, at arsenens valenselektroner er fem. Der er en artikel på denne side, der beskriver elektronkonfigurationen af arsen, du kan læse den, hvis du vil.
Hvordan beregner du antallet af valenselektroner i et arsenatom?
nu vil vi vide, hvordan man nemt kan bestemme valenselektronerne af arsen. Valenselektronen skal bestemmes ved at følge et par trin. Elektronkonfigurationen er en af dem. Det er ikke muligt at bestemme valenselektronen uden elektronkonfiguration.
at kende elektronkonfigurationen på den rigtige måde er det meget nemt at bestemme valenselektronerne for alle elementerne. Der er en artikel offentliggjort på denne side, der beskriver elektronkonfigurationen, du kan læse den, hvis du vil. Denne artikel diskuterer imidlertid kort elektronkonfiguration.
forsker Niels Bohr var den første til at give en ide om atomets kredsløb(shell). Han leverede en model af atomet i 1913. Den komplette ide om bane er givet der. Atomets elektroner drejer sig om kernen i en bestemt cirkulær vej. Disse cirkulære stier kaldes kredsløb (skal). Disse baner udtrykkes af n.
K er navnet på den første bane(skal), L er den anden, M er den tredje, N er navnet på den fjerde skal. Elektronholdekapaciteten for hver bane er 2n2.
nu,
- n = 1 For k kredsløb.
elektronholdekapaciteten for K-bane er 2N2 = 2 liter 12 = 2 elektroner. - for L kredsløb, n = 2.
l-kredsløbets elektronholdekapacitet er 2N2 = 2 liter 22 = 8 elektroner. - n=3 For m kredsløb.
den maksimale elektronholdekapacitet I m kredsløb er 2N2 = 2 liter 32 = 18 elektroner. - n=4 For n bane.
den maksimale elektronholdekapacitet i n bane er 2N2 = 2 liter 42 = 32 elektroner.
ud over denne metode kan elektronkonfiguration udføres gennem underbaner. Den tyske fysiker Aufbau foreslog først en ide om elektronkonfiguration gennem underbaner. Aufbau-metoden er at udføre elektronkonfiguration gennem sub-energiniveauet.
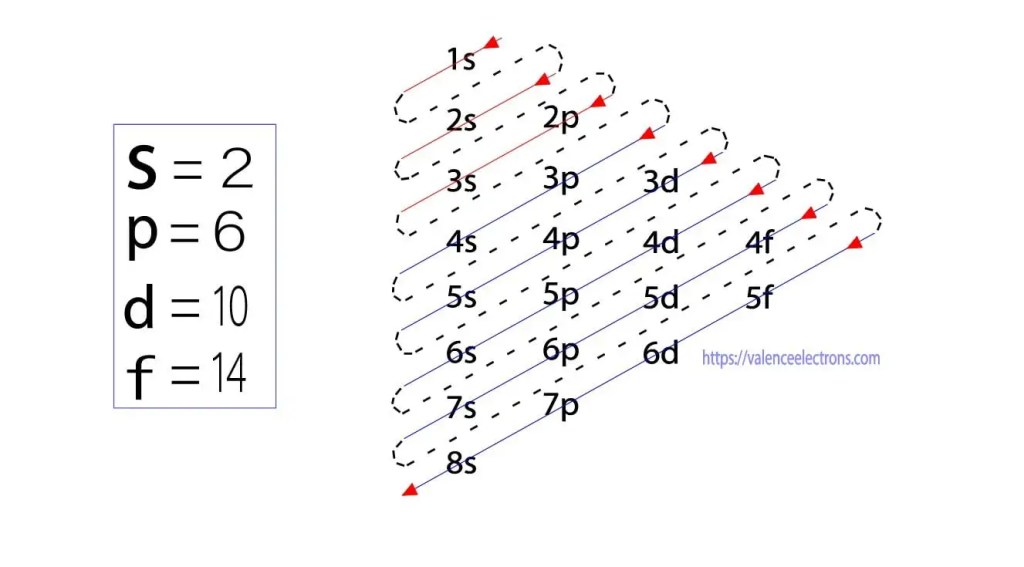
disse sub-orbitaler udtrykkes af ‘l’. Aufbau-princippet er, at elektronerne, der er til stede i atomet, først vil fuldføre den laveste energi orbital og derefter gradvist fortsætte med at fuldføre den højere energi orbital. Disse orbitaler er navngivet s, p, d, f. elektronholdekapaciteten for disse orbitaler er s = 2, p = 6, d = 10 og f = 14.
valenselektroner kan dog let identificeres ved at arrangere elektroner i henhold til Bohr-princippet. Nu vil vi lære at bestemme valenselektronen af arsen(As).
Trin-1: Bestemmelse af det samlede antal elektroner i arsen(As)
1.Vi skal kende det samlede antal elektroner i arsenatomet. For at kende antallet af elektroner skal du kende antallet af protoner i arsen. Og for at kende antallet af protoner, skal du kende atomnummeret på arsenelementet.
for at kende atomnummeret skal vi tage hjælp fra et periodisk bord. Det er nødvendigt at kende atomnummeret af arsen(As) elementer fra det periodiske bord. Atomnummeret er antallet af protoner. Og elektroner svarende til protoner er placeret uden for kernen.

det vil sige, Vi kan endelig sige, at der er elektroner svarende til atomnummeret i arsenatomet. Fra det periodiske system ser vi, at atomnummeret af arsen(As) er 33. Det vil sige, at arsenatomet har i alt treogtredive elektroner.
Trin-2: Behov for at gøre elektronkonfiguration af arsen
Trin-2 er meget vigtigt. I dette trin skal elektronerne af arsen arrangeres. Vi ved, at arsen(As) atomer har i alt treogtredive elektroner. Elektronkonfigurationen af arsenet viser, at der er to elektroner i K-skallen, otte i L-skallen, atten I M-skallen og fem i n-skallen(bane).

det vil sige, den første skal af arsen har to elektroner, den anden skal har otte elektroner, den 3.Skal har atten elektroner og den 4. Skal(sidste bane) har fem elektroner. Skal af arsen (As) er 2, 8, 18, 5. Elektronkonfigurationen af arsen gennem underbanen er 1s2 2s2 2p6 3s2 3P6 4S2 3d10 4P3.
Trin-3: Bestem valensskallen og beregne de samlede elektroner
det tredje trin er at diagnosticere valensskallen. Den sidste skal efter elektronkonfigurationen kaldes valensskallen (kredsløb). Det samlede antal elektroner i en valensskal kaldes en valenselektron. Elektronkonfigurationen af arsen (As) viser, at den sidste skal af arsen har fem elektroner. Derfor har arsenatomer 5 valenselektroner.
hvor mange valenselektroner har arsenion(As3 -)?
de elementer, der har 5, 6 eller syv elektroner i den sidste skal(bane), modtager elektronerne i den sidste skal under bindingsdannelse. De elementer, der modtager elektroner og danner bindinger kaldes anioner. Det vil sige, arsen(As) er et anionelement.
As + 3e– liter As3-
under dannelsen af arsenbindinger modtager den sidste skal elektroner og omdanner dem til arsenioner(As3-). Elektronkonfigurationen af arsenioner(As3-) er 1s2 2s2 2p6 3s2 3P6 4S2 3d10 4P6.
elektronkonfigurationen af arsenioner viser, at arsenioner(As3-) har fire skaller, og den sidste skal har otte elektroner(4S2 4P6). Elektronkonfigurationen viser, at arsenatomet har erhvervet elektronkonfigurationen af krypton. Da den sidste skal af en arsenion har otte elektroner, er valenselektronerne af arsenioner(As3-) otte.
hvad er arsenens Valens?
et atoms evne til at forbinde et andet atom under dannelsen af et molekyle kaldes Valens (Valens). Antallet af uparrede elektroner i den sidste bane af et element er valensen af dette element. I elektronkonfigurationen for arsen(As) ser vi, at der findes fem elektroner i arsenens sidste skal. Derfor er arsenets Valens(As) 5.

igen bestemmes Valens ud fra elektronkonfigurationen af elementet i ophidset tilstand. Elektronkonfigurationen af arsen i ophidset tilstand er As*(33) = 1s2 2s2 2p6 3s2 3P6 4S2 3d10 4ph1 4py1 4ps1. Her viser elektronkonfigurationen af arsen, at der findes tre uparrede elektroner i den sidste skal. I dette tilfælde er arsenatomets Valens 3.
iltningstilstandene for arsen afhænger af bindingsdannelsen. Iltningstilstanden for arsen er + 3. Iltningstilstanden af arsen + 3 er blevet anvendt i galliumarsenid (GaAs). Valensen af arsen i denne forbindelse er 3.