Mange av oss kan ha hatt den uheldige opplevelsen av å legge soda «feil» til bassengvannet, noe som resulterer i et basseng som ser ut som det er fylt med melk. Faktisk refererer vi til det som «melking» et basseng. Hvorfor skjer det?
når vi for eksempel bestemmer oss for å heve ph i et basseng fra 7,2 til 7,6, beregner vi hvor mye soda som kreves for at størrelsesbassenget skal oppnå en økning på 0,4 ph-enheter. En løsning av soda (natriumkarbonat) har en pH på over 11, så når det legges til bassengvann, går pH opp og øker alkaliteten også. Men da vi fant en dose, skal den krukken full av pulver ideelt sett distribueres umiddelbart gjennom hele bassenget. Når vi går til den grunne enden og bare dumper hele krukken i en enkelt slug, kan vi midlertidig ha en liten mengde vann, 20 eller 30 liter verdt, med en pH i 10-området.
Hva gjør det med vannet? Vel, soda er normalt meget løselig i vannet. Det går i oppløsning nesten umiddelbart, men det øker også pH og metningsindeksen høy nok til å forårsake kalsiumbikarbonat (oppløst kalsium i bassengvannet eller kalsiumhardhet) for å utfelle. Den hvite skyen du ser er faktisk ikke soda, men utfelt kalsiumkarbonat.
RELATERT: Viktige Misforståelser og Problemer I Bassengvannkjemi (Del I)
 når vi dumper en stor slug av soda i bassenget, lager vi midlertidig et lite område med høy pH, kanskje i 10-området, noe som forårsaker nedbør av kalsiumkarbonat.
når vi dumper en stor slug av soda i bassenget, lager vi midlertidig et lite område med høy pH, kanskje i 10-området, noe som forårsaker nedbør av kalsiumkarbonat.
hvis en liten mengde kalsiumkarbonat er utfelt produsere noen skydekke, det generelt og gradvis, vanligvis i løpet av minutter, re-oppløses og klarner opp. Det tilsatte karbonatet (fra soda) blander seg gjennom bassenget, endrer og blir bikarbonater av kalsium og natrium, og pH og alkaliniteten stiger, som planlagt. Men hvis for mye kalsium utfelles, kan det utløse reaksjoner som produserer større partikler eller krystaller som tar mye lengre tid og er mye vanskeligere å oppløse tilbake i resten av vannet.
når et basseng melkes, forklarer vi situasjonen til kunden og legger ut to valg: Vi kan enten oppløse kalsiumet på nytt (ved å senke pH-verdien ved hjelp av syre til metningsindeksverdien er lav nok, kalsiumkarbonatet blir bikarbonat og gjenoppløses) eller filtrere ut bunnfallet.
fordelen med det første alternativet er at innen en time eller to kan bassengvannet være klart igjen, men med alt (inkludert kalsium!) tilbake der den kom fra. Fordelen med den andre er at vi har myknet bassenget (redusert kalsiumhardhetsnivået), men bassenget blir overskyet gjennom filtreringsprosessen, noe som kan ta dager eller en uke.
Å Vite dette betyr selvsagt at vi kan myke kundens bassengvann og redusere kalsiumhardhetsnivået, med vilje, ved å manipulere vannets metningskjemi ved hjelp av ionbytterprosessen beskrevet ovenfor.
reaksjonen er som følger:
BRUK AV SODA:
Tilsetning av natriumkarbonat til bassengets oppløste kalsiumhardhet (kalsiumbikarbonat) resulterer i filtrerbart kalsiumkarbonatfelling og natron.
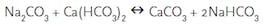
for eksempel hjalp vi en bassengeier hvis basseng på 18 000 gallon hadde et kalsiumhardhetsnivå på 1196 ppm, en pH på 8,2 og en total alkalitet på 180. Bassenget eieren ikke ønsker å drenere bassenget med mindre de virkelig måtte, så de kontaktet oss. Vi la til 70 pounds soda til bassenget. Dette utfelt rundt 70 pounds av kalsiumkarbonat, som ble filtrert fra bassenget. De resulterende avlesningene var et kalsiumhardhetsnivå på 589 ppm, en pH på 7,5 og en total alkalitet på 158.
(ved hjelp av vårt laboratorieanalyseutstyr kan vi nøyaktig bestemme kalsiumhardheten.)
RELATERT: Viktige Misforståelser og Problemer I Bassengvannkjemi (Del II)
Vent litt! Bør ikke legge til 70 POUNDS soda forårsake EN STOR økning i pH og alkalitet? Faktisk, og kanskje overraskende, nei. Siden det er en nesten en-til-en utveksling av alkaliske materialer (natriumkarbonat i og kalsiumkarbonat ut), ph og alkalitet faktisk bodde omtrent det samme.
Kaustisk soda (natriumhydroksid Eller NaOH) kan brukes i stedet for soda for å utfelle kalsium (som også kan utfelle ut noe magnesium i vannet). Mindre materiale er nødvendig for samme resultat, men natriumhydroksid kan ikke være tilgjengelig og praktisk som soda for de fleste serviceteknikere.
 FØR (venstre) og etter (høyre)
FØR (venstre) og etter (høyre)
BRUK AV KAUSTISK SODA:
Tilsetning av natriumhydroksid til bassengets oppløste kalsiumhardhet (kalsiumbikarbonat) resulterer i filtrerbart kalsiumkarbonatfelling, vann og natron.
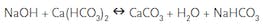
det er variabler i hvor mye kalsium er utfelt fra en gitt mengde soda. Disse inkluderer vanntemperatur (jo høyere temperatur, jo mer utfelling), eksisterende nivå av kalsium og addisjonsmetode(jo mer «lokalisert» addisjonsmetoden, jo mer utfelling).
Filtrering av kalsiumkarbonat kan tette noen filtre ganske raskt. Filteret vi brukte var en kassett – Stil D. E. enhet uten D. E. lagt. Med kundens sugepumpe koblet til den, tok det tre dager å fjerne alt bunnfallet fra bassenget, med daglig rengjøring av patronen.
Vi har funnet ut at vi kan bruke en enkel anvendelse av kjemi for å redde en bassengeier fra nødvendigheten av å tømme bassenget, og at kalsiumkarbonatfellingen ikke skal holde seg til bassengoverflaten hvis den kontinuerlig børstes og fjernes ved filtrering raskt.